
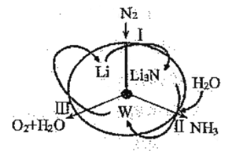
【题目】科学工作者研发了一种![]() 的系统,借助锂循环可持续合成氨,其原理如图所示。下列说法不正确的是( )
的系统,借助锂循环可持续合成氨,其原理如图所示。下列说法不正确的是( )
A.过程Ⅰ得到的![]() 的电子式为
的电子式为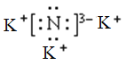
B.过程Ⅱ生成W的反应为![]()
C.反应Ⅲ中能量转化的方式是电能转变为化学能
D.过程Ⅰ、Ⅱ、Ⅲ均为氧化还原反应
【答案】D
【解析】
由图示可知,反应I是N2和Li反应生成Li3N,化学方程式为:N2+6Li![]() 2Li3N;反应II是Li3N和H2O反应生成LiOH和NH3,化学方程式为Li3N+3H2O=3LiOH+NH3,即W为LiOH;反应III是由LiOH获得了金属Li和氧气和水,故反应III是对LiOH溶液进行了电解,据此分析。
2Li3N;反应II是Li3N和H2O反应生成LiOH和NH3,化学方程式为Li3N+3H2O=3LiOH+NH3,即W为LiOH;反应III是由LiOH获得了金属Li和氧气和水,故反应III是对LiOH溶液进行了电解,据此分析。
A.Li3N为离子化合物,锂离子与氮离子通过离子键结合,其电子式为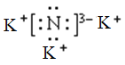 ,故A正确;
,故A正确;
B.反应II是Li3N和H2O反应生成LiOH和NH3,化学方程式为Li3N+3H2O=3LiOH+NH3↑,故B正确;
C.反应III是由LiOH获得了金属Li、氧气和水,故反应III是对LiOH溶液进行了电解,电能转化为化学能,故C正确;
D.反应II是Li3N和H2O反应生成LiOH和NH3,反应中没有元素化合价的变化,不是氧化还原反应,故D错误;
故答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】能够说明硫的非金属性比氯弱的事实有
①![]() 与铁反应生成
与铁反应生成![]() ,S与铁反应生成FeS
,S与铁反应生成FeS
②![]() 和
和![]() 的混合气,经强光照射可剧烈反应,而S与
的混合气,经强光照射可剧烈反应,而S与![]() 反应需较高温度
反应需较高温度
③将![]() 通入氢硫酸中可置换出硫
通入氢硫酸中可置换出硫
④常温时硫单质为固态而氯单质为气态.
A.①③B.①②③C.②④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代《天工开物》记载了“火法”冶炼锌的方法:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷淀,毁罐取出,…,即倭铅也”,现代工业开发了用NH3—NH4Cl水溶液浸出氧化锌烟灰(主要成分为ZnO 、少量Pb、CuO和As2O3)制取高纯锌的工艺流程如图所示。
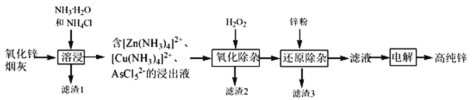
请回答下列问题:
(1)《天工开物》中炼锌的方法中“泥封”的目的是____________。
(2)滤渣1的主要成份分别是_______(填化学式),“过滤”用到的玻璃仪器是__________。
(3) “溶浸”时,氧化铜参与反应的相关离子方程式是________;“溶浸”时可以适当升高温度,但不宜过高,其原因是________________。
(4) “氧化除杂”的目的是将AsCl52-转化为As2O5胶体,再经吸附聚沉除去,溶液始终接近中性,该反应的离子方程式是_____________________。
(5) “电解”含 [Zn(NH3)4]2+的溶液,阴极放电的电极反应式是_________。阳极区产生一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是_______(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的使用正确的是( )
A.在基态多电子原子中,p轨道电子的能量一定高于s轨道电子的能量
B.Fe原子的外围电子排布图为![]()
C.氧的电负性比氮大,故氧元素的第一电离能比氮元素的第一电离能大
D.铜原子的外围电子排布式为3d94s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为__、__(填标号)。
A.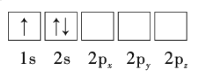
B.
C.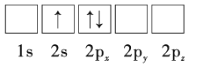
D.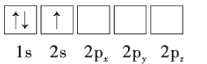
(2)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.原子核外电子排布式为![]() 的原子与原子核外电子排布式为
的原子与原子核外电子排布式为![]() 的原子对应元素的化学性质相似
的原子对应元素的化学性质相似
B.![]() 的最外层电子排布式为
的最外层电子排布式为![]()
C.基态铜原子外围电子排布图为![]()
D.基态碳原子最外层电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物在生产、生活中有广泛应用,其吸收和处理也十分重要。回答下列问题:
1.SO2具有还原性,写出将SO2气体通入 FeCl3溶液中的离子方程式_________,并标出电子转移的数目及方向。_____________________________________________________________
2.在Na2SO3溶液中滴加酚酞,溶液变红色,若在该溶液中滴入过量的BaCl2溶液,现象是_________,请结合离子方程式,运用平衡原理进行解释_____________________。
3.等体积等物质的量浓度的 NaClO溶液与Na2SO3溶液混合后,溶液显______性。此时溶液中浓度相等的微粒是___________________________________________。
4.已知:H2S:Ki1=1.3×10-7Ki2=7.1×10-15 H2CO3:Ki1=4.3×10-7Ki2=5.6×10-11
含H2S尾气用足量的Na2CO3溶液来吸收。写出离子反应方程式。____________
常温时,等体积等浓度的Na2S和Na2CO3溶液的离子总数:N前___N后(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 标准状况下,11.2L14CO2含有的中子数为11NA
B. 5.6gFe粉与足量S粉加热充分反应转移的电子数为0.2NA,
C. 1molNa2O2固体中所含离子数目为4NA
D. 1LpH=6的纯水中含有OHˉ的数目为10-8NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com