



 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯化钠 | B.二氧化硅 | C.干冰 | D.二氧化硫 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.都不正确 | B.只有①③⑤正确 |
| C.只有②④⑤正确 | D.只有①②⑥正确 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 杂化,其键角比水分子 (填“大”或“小”)。
杂化,其键角比水分子 (填“大”或“小”)。
 氢键的“键能”)是 kJ / mol 。
氢键的“键能”)是 kJ / mol 。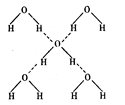
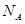 表示阿伏加德罗常数,则CaO晶胞体积为 cm3。
表示阿伏加德罗常数,则CaO晶胞体积为 cm3。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com