
【题目】科研人员设计一种电化学反应器以Na2SO4溶液为电解质,负载纳米MnO2的导电微孔钛膜和不锈钢为电极材料。这种反应器可用于正丙醇氧化合成丙酸,装置示意图如下图。以下叙述错误的是( )

A. 不锈钢作阴极
B. 微孔钛膜电极发生的电极反应CH3CH2CH2OH+H2O+4e-=CH3CH2COOH+4H+
C. 使用Na2SO4溶液是为了在电解时增强溶液导电性
D. 反应器工作时料槽中正丙醇分子向微孔钛膜移动
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】自然界中金属硫化物之间存在原电池反应。下图所示装置中电极Ⅰ为方铅矿(PbS),电极Ⅱ为含有方铅矿的硫铁矿,当有电解质溶液按如图所示方向流经该装置时,电流表指针偏转。若电极Ⅱ质量不断减少,a处溶液中加入KSCN溶液未出现红色,加入CuSO4溶液未出现黑色沉淀。下列有关说法中正确的是( )
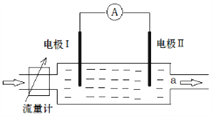
A.工业上利用该原理富集铁
B.电极Ⅱ作正极
C.溶液流经该装置后pH增大
D.该装置负极的电极反应为FeS2—15e—+8H2O=Fe3++2SO42—+16H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答以下问题:
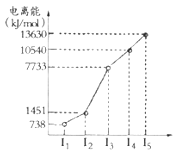
(1)第四周期的某主族元素,其第一至五电离能数据如图所示,则该元素对应原子的M层电子排布式为____________。
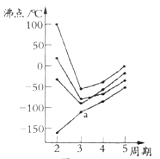
(2)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是______。
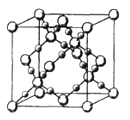
(3)CO2在高温高压下所形成的晶体其晶胞如图所示.该晶体的熔点比SiO2晶体________(填“高”或“低”),该晶体中碳原子轨道的杂化类型为______。
(4)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为____(填序号)。
A.离子键 B.配位键 C.氢键 D.非极性共价键
若化合物(CH3)3N能溶于水,试解释其原因:_________________________。
(5)一种新型储氢化合物A是乙烷的等电子体,其相对分子质量为30.8,且A是由第二周期两种氢化物形成的化合物。加热A会慢慢释放氢气,同时A转化为化合物B,B是乙烯的等电子体。化合物A的结构式为__________________(若含有配位键,要求用箭头表示)
(6)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为______________________;正四面体形阳离子中键角小于PCl3的键角原因为_____________________________;若PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因______________________。
(7)氢化铝钠(NaAlH4)是一种新型轻质材料, NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如下图所示。NaAlH4晶体中,与Na+紧邻且等距的AlH4- 有_________个;NaAlH4晶体的密度为___________g·cm-3(用含a的代数式表示)。
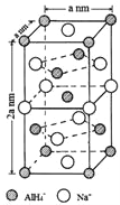
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下现象与电化腐蚀无关的是
A. 黄铜(铜锌合金)制作的铜锣不易产生铜绿
B. 生铁比软铁芯(几乎是纯铁)容易生锈
C. 铁质器件附有铜质配件,在接触处易生铁锈
D. 银质奖牌久置后表面变暗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为配制480 mL 0.2 mol·L-1 NaCl溶液的示意图。

回答下列问题:
(1)在容量瓶的使用方法中,下列操作不正确的是________(填字母)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用胶头滴管滴加蒸馏水到刻度线
D.溶解过程中,要等烧杯中溶液冷却到室温再转入容量瓶
(2)①中应称NaCl________ g;②选择容量瓶的规格____________。
(3)玻璃棒在②、③两步中的作用分别是____________________________、____________________________。
(4)若出现如下情况,对所配溶液浓度有何影响?(填“偏高”“偏低”或“无影响”)
A.某同学在第①步称量时物品和砝码放反了 ________。
B.某同学在第⑧步观察液面时仰视________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一
I.NO和CO气体均为汽车尾气的成分,目前降低尾气的可行方法是在汽车排气管上安装催化转化器,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
已知反应中相关键能数据如下:
化学键 | C | N | N | C=O |
键能/kJ·mol-1 | 1076 | 632 | 946 | 750 |
(1)由此计算△H=__________。
(2)在一定温度下,将2.0molNO、2.4molCO通入到容积固定为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
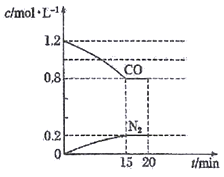
①有害气体NO的转化率为__________。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是__________ (填序号)。
a.缩小容器体积 b.催化剂 c.降低温度 d.再通入2.0molNO
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,平衡将__________ (填“正向”或“逆向”)移动。
Ⅱ.SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法,反应原理为:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g)△H<0
4N2(g)+6H2O(g)△H<0
(3)该法可能发生副反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),减少副反应的主要措施是___________(写一条即可)。
4NO(g)+6H2O(g),减少副反应的主要措施是___________(写一条即可)。
(4)其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图。
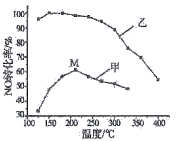
①工业上选择催化剂__________(填“甲”或“乙”),原因是____________。
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率______(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。高于210℃时,NO转化率降低的原因可能是__________。(写一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对化学反应的速率和限度的叙述正确的是( )
A.增加某一反应物的用量一定能够加快该反应的速率
B.化学反应的限度是不可改变的
C.化学反应进行的时间越长该反应的限度越大
D.化学反应达到限度时,正逆反应速率相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com