
【题目】下列各组性质的比较中,不正确的是
A.碱性:NaOH>Mg(OH)2B.热稳定性:NH3>PH3
C.金属性:K>NaD.原子半径:Cl>S
科目:高中化学 来源: 题型:
【题目】已知33As、35Br位于同一周期.下列关系正确的是( )
A.原子半径:As>Cl>P
B.热稳定性:HCl>AsH3>HBr
C.还原性:As3﹣>S2﹣>Cl﹣
D.酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所给出的装置图回答下列问题:
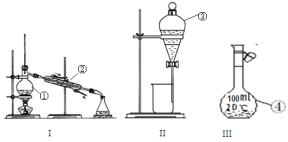
(1)①~④中,使用前必须检查是否漏水的是____________(填仪器序号)。
(2)分离溴水中的溴应先选择装置_____(填Ⅰ、Ⅱ、Ⅲ或Ⅳ序号,下同),进行操作A_______(填操作名称,下同);再选装置_____,进行操作B________;操作A需在溴水中加一种试剂,选择这一试剂时,下列性质你认为哪些是必需的:_______(填字母)。
A. 常温下为液态 B. Br2在其中溶解程度小 C. 与水互不相溶
D. 密度比水大 E. 与Br2不反应 F. 溶解Br2后呈现橙红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某NaOH样品中含有少量Na2CO3、NaHCO3和H2O,经分析测定,其中含NaOH83.4%(质量分数,下同), NaHCO3 8.8%,Na2CO3 6.4%,H2O 1.4%。将此样品若干克投入到49克21%的稀硫酸中,待反应完全后,需加入20克9.0%的NaOH溶液方能恰好中和。则蒸发中和后的溶液可得固体质量接近于
A. 25 B. 20 C. 15 D. 10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是 ( )
A. 0.1 mol·L-1 NH4HS溶液中有:c(NH![]() )+c(NH3·H2O)=c(HS-)+c(S2-)+c(H2S)
)+c(NH3·H2O)=c(HS-)+c(S2-)+c(H2S)
B. 25 ℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合后,c(NH![]() )=c(Cl-),则a>0.01mol·L-1
)=c(Cl-),则a>0.01mol·L-1
C. 等浓度的HCN和NaCN等体积混合后溶液呈碱性,则有:c(CN-)>c(HCN)
D. 等体积等pH的醋酸和盐酸溶液,分别与一定浓度的氢氧化钠溶液完全中和,醋酸消耗的氢氧化钠溶液体积多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员设计一种电化学反应器以Na2SO4溶液为电解质,负载纳米MnO2的导电微孔钛膜和不锈钢为电极材料。这种反应器可用于正丙醇氧化合成丙酸,装置示意图如下图。以下叙述错误的是( )

A. 不锈钢作阴极
B. 微孔钛膜电极发生的电极反应CH3CH2CH2OH+H2O+4e-=CH3CH2COOH+4H+
C. 使用Na2SO4溶液是为了在电解时增强溶液导电性
D. 反应器工作时料槽中正丙醇分子向微孔钛膜移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器.相同条件下充入等物质的量的NO2气体,且起始时体积相同,发生反应:2NO2(g)N2O4(g)△H<0.一段时间后相继达到平衡状态..下列说法中错误的是( )
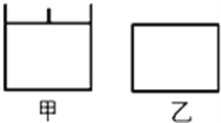
A. 该反应的平衡常数表达式K=c(N2O4)/c2(NO2)
B. 若乙容器内气体的压强保持不变,说明反应已达到平衡状态
C. 平衡时NO2体积分数:甲>乙
D. 达到平衡所需时间,甲所需时间短
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com