
【题目】根据所给出的装置图回答下列问题:
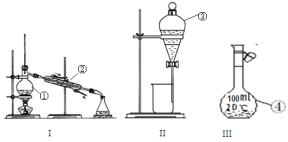
(1)①~④中,使用前必须检查是否漏水的是____________(填仪器序号)。
(2)分离溴水中的溴应先选择装置_____(填Ⅰ、Ⅱ、Ⅲ或Ⅳ序号,下同),进行操作A_______(填操作名称,下同);再选装置_____,进行操作B________;操作A需在溴水中加一种试剂,选择这一试剂时,下列性质你认为哪些是必需的:_______(填字母)。
A. 常温下为液态 B. Br2在其中溶解程度小 C. 与水互不相溶
D. 密度比水大 E. 与Br2不反应 F. 溶解Br2后呈现橙红色
【答案】③④ Ⅱ 萃取(或萃取分液) Ⅰ 蒸馏 ACE
【解析】
(1)根据分液漏斗和100mL容量瓶在使用前要检查是否漏水;
(2)萃取利用溶质在不同溶剂中溶解度不同,用一种溶剂把溶质从它与另一溶剂所组成的溶液中提取出来,然后分液;根据溴与四氯化碳的沸点不同可用蒸馏分离;萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应。
(1)因分液漏斗和100mL容量瓶在使用前要检查是否漏水,蒸馏烧瓶、冷凝管不需要检查是否漏水,
因此,本题正确答案是:③④;
(2)溴在四氯化碳中的溶解度较在水中大,并且四氯化碳和水互不相溶,可用萃取的方法分离,接着可用分液方法将两层液体分开,应选择装置Ⅱ;
四氯化碳易挥发,可用蒸馏的方法分馏得到四氯化碳,应选择装置Ⅰ;
溴在萃取剂中的溶解度大于在水中的溶解度,萃取剂和水不互溶,且萃取剂和溴不反应,
因此,本题正确答案是:Ⅱ; 萃取(或萃取分液);Ⅰ; 蒸馏;ACE。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】25℃时,NH4+的水解平衡常数为Kb=5.556×10 -10。该温度下,用0.100 mol·L-1的氨水滴定10.00ml 0.050 mol·L-1的二元酸H2A的溶液,滴定过程中加入氨水的体积(V 与溶液中lg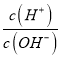 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
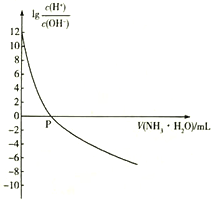
A. H2A的电离方程式为H2A![]() H++A2-
H++A2-
B. 25℃时,Kb(NH3·H2O)=1.8×10-5
C. P点时加入氨水的体积为10 mL
D. 向H2A溶液中滴加氨水的过程中,水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中金属硫化物之间存在原电池反应。下图所示装置中电极Ⅰ为方铅矿(PbS),电极Ⅱ为含有方铅矿的硫铁矿,当有电解质溶液按如图所示方向流经该装置时,电流表指针偏转。若电极Ⅱ质量不断减少,a处溶液中加入KSCN溶液未出现红色,加入CuSO4溶液未出现黑色沉淀。下列有关说法中正确的是( )
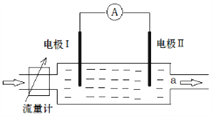
A.工业上利用该原理富集铁
B.电极Ⅱ作正极
C.溶液流经该装置后pH增大
D.该装置负极的电极反应为FeS2—15e—+8H2O=Fe3++2SO42—+16H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列浓度关系正确的是
A.0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全:c (NH4+)>c (OH-)>c (SO42-)>c (H+)
B.0.1 mol/L的KOH溶液中通入标准状况下的CO2气体3.36 L,所得溶液中:c (K+)+c (H+)=c (CO32-)+c (HCO3-)+c (OH-)
C.0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (HCN)>c (Na+)>c (CN-)>c (OH-)>c (H+)
D.pH相同的NaOH溶液、CH3COONa溶液、Na2CO3溶液、NaHCO3溶液的浓度:c (NaOH)<c (CH3COONa)<c (NaHCO3)<c (Na2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁和石墨作电极电解酸性废水,可将废水中的PO43-以FePO4(不溶于水)的形式除去,其装置如图所示。下列说法正确的是( )
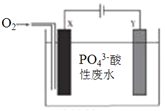
A. 若X、Y电极材料连接反了,则仍可将废水中的PO43-除去
B. X极为石墨,该电极上发生氧化反应
C. 电解过程中Y极周围溶液的pH减小
D. 电解时废水中会发生反应:4Fe2++O2+4H++4PO43- =4FePO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答以下问题:
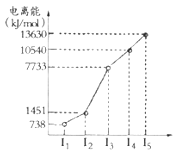
(1)第四周期的某主族元素,其第一至五电离能数据如图所示,则该元素对应原子的M层电子排布式为____________。
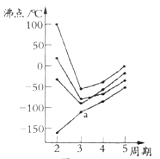
(2)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是______。
(3)CO2在高温高压下所形成的晶体其晶胞如图所示.该晶体的熔点比SiO2晶体________(填“高”或“低”),该晶体中碳原子轨道的杂化类型为______。
(4)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为____(填序号)。
A.离子键 B.配位键 C.氢键 D.非极性共价键
若化合物(CH3)3N能溶于水,试解释其原因:_________________________。
(5)一种新型储氢化合物A是乙烷的等电子体,其相对分子质量为30.8,且A是由第二周期两种氢化物形成的化合物。加热A会慢慢释放氢气,同时A转化为化合物B,B是乙烯的等电子体。化合物A的结构式为__________________(若含有配位键,要求用箭头表示)
(6)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为______________________;正四面体形阳离子中键角小于PCl3的键角原因为_____________________________;若PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因______________________。
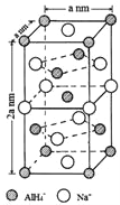
(7)氢化铝钠(NaAlH4)是一种新型轻质材料, NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如下图所示。NaAlH4晶体中,与Na+紧邻且等距的AlH4- 有_________个;NaAlH4晶体的密度为___________g·cm-3(用含a的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com