
【题目】下列叙述中不正确的是 ( )
A. 0.1 mol·L-1 NH4HS溶液中有:c(NH![]() )+c(NH3·H2O)=c(HS-)+c(S2-)+c(H2S)
)+c(NH3·H2O)=c(HS-)+c(S2-)+c(H2S)
B. 25 ℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合后,c(NH![]() )=c(Cl-),则a>0.01mol·L-1
)=c(Cl-),则a>0.01mol·L-1
C. 等浓度的HCN和NaCN等体积混合后溶液呈碱性,则有:c(CN-)>c(HCN)
D. 等体积等pH的醋酸和盐酸溶液,分别与一定浓度的氢氧化钠溶液完全中和,醋酸消耗的氢氧化钠溶液体积多
【答案】C
【解析】A.根据NH4HS溶液中的物料守恒可得:c(NH4+)+c(NH3·H2O)=c(HS-)+c(S2-)+c(H2S)=0.1mol/L,选项A正确;B. 25 ℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合后,c(NH![]() )=c(Cl-),根据电荷守恒知c(NH
)=c(Cl-),根据电荷守恒知c(NH![]() )+ c (H+)=c(Cl-)+ c(OH-),溶液应呈中性,故氨水应过量,则a>0.01mol·L-1,选项B正确;C. 等浓度的HCN和NaCN等体积混合后溶液呈碱性c (H+)< c(OH-),根据电荷守恒有c (Na+)+ c (H+)=c(CN-)+ c(OH-),则有:c (Na+)>c(CN-),HCN的电离小于CN-的水解, c(CN-)<c(HCN),选项C不正确;D、等体积等pH的醋酸和盐酸溶液,醋酸的物质的量大于盐酸,分别与一定浓度的氢氧化钠溶液完全中和,醋酸消耗的氢氧化钠溶液体积多,选项D正确。答案选C。
)+ c (H+)=c(Cl-)+ c(OH-),溶液应呈中性,故氨水应过量,则a>0.01mol·L-1,选项B正确;C. 等浓度的HCN和NaCN等体积混合后溶液呈碱性c (H+)< c(OH-),根据电荷守恒有c (Na+)+ c (H+)=c(CN-)+ c(OH-),则有:c (Na+)>c(CN-),HCN的电离小于CN-的水解, c(CN-)<c(HCN),选项C不正确;D、等体积等pH的醋酸和盐酸溶液,醋酸的物质的量大于盐酸,分别与一定浓度的氢氧化钠溶液完全中和,醋酸消耗的氢氧化钠溶液体积多,选项D正确。答案选C。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】混合物分离和提纯常用下图装置进行,按要求回答下列问题:
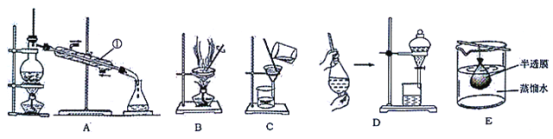
(1)仪器①的名称__________。
(2)明胶是水溶性蛋白质混合物,溶于水形成胶体。分离明胶的水溶液与Na2CO3、Na2SO4的混合溶液应选用装置的为(用上图字母填写)_____。如何证明SO42-已分离出来_____。
(3)在装置D中加入10 mL碘水,然后再注入4 mL CCl4,盖好玻璃塞,按操作规则反复振荡后静置观察到的现象是:___________________________________。操作完毕后,为得到碘并回收CCl4可用________法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质子核磁共振谱是研究有机化合物结构的有力手段之一。结构中的等效氢原子核磁共振谱中都给出了相应的峰值(信号),谱中峰的强度与结构中的H原子数成正比。试回答:
(1)结构简式为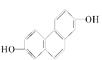 的有机化合物,在核磁共振谱中观察峰给出的强度之比为___________。
的有机化合物,在核磁共振谱中观察峰给出的强度之比为___________。
(2)实践中可根据核共振谱上观察到H原子给出的峰值情况,确定有机化合物的结构。分子式为C3H6O2的链状有机化合物核磁共振谱上峰给出的稳定强度仅有四种,它们分别是①3∶3,②3∶2∶1,③3∶1∶1∶1,④1∶2∶2∶1。
请分别推断出其对应的结构简式:
①________________________; ② ___________________________;
③________________________; ④ ___________________________。
(3)测得CH3CH2CH2CH3化合物核磁共振谱上可观察到两种峰,而CH3CH=CHCH3的核磁共振谱有4种峰,结合其空间结构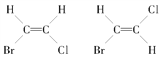 ,解释产生4个峰的原因:_______________。
,解释产生4个峰的原因:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题
(1)向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体的离子方程式为_______________________。
(2)Ca(OH)2的电离方程式为_______________。
(3)现有下列物质:①干冰②NaHCO3晶体③氨水④纯醋酸⑤FeCl3溶液⑥铜⑦蔗糖⑧熔化的NaCl,其中属于非电解质的是___________(填序号,下同),属于强电解质的有____________,属于弱电解质的有________________,能导电的物质有________________。
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示。向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀H2SO4至恰好完全反应。在此实验过程中,此实验中观察到的现象有___________________________________________。
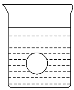
(5)下列说法正确的是_________________。
①碱性氧化物一定是金属氧化物;
②酸性氧化物一定是非金属氧化物;
③乳浊液静止后分层;
④Mg2+、SO42-、Fe3+、X四种离子以物质的量之比1:2:1:1大量共存于同一水溶液中,X可能是NO3﹣;
⑤碳酸钙是强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为配制480 mL 0.2 mol·L-1 NaCl溶液的示意图。

回答下列问题:
(1)在容量瓶的使用方法中,下列操作不正确的是________(填字母)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用胶头滴管滴加蒸馏水到刻度线
D.溶解过程中,要等烧杯中溶液冷却到室温再转入容量瓶
(2)①中应称NaCl________ g;②选择容量瓶的规格____________。
(3)玻璃棒在②、③两步中的作用分别是____________________________、____________________________。
(4)若出现如下情况,对所配溶液浓度有何影响?(填“偏高”“偏低”或“无影响”)
A.某同学在第①步称量时物品和砝码放反了 ________。
B.某同学在第⑧步观察液面时仰视________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.含离子键的化合物是离子化合物,含共价键的化合物是共价化合物
B.离子键的形成过程中一定有电子得失
C.第ⅠA、ⅡA族元素与第ⅥA、ⅦA族元素一定形成离子键
D.离子键与共价键的本质都是静电作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D的电负性由小到大的顺序为________________。
(2)C的最高价氧化物分子是________(填“极性”或“非极性”)分子。
(3)与B同主族元素X,其气态氢化物是同主族元素的氢化物中沸点最高的,解释X的气态氢化物极易溶于水的原因:①_______________②_______________
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断E(CO)5的晶体类型为____;E(CO)5在一定条件下发生分解反应:E(CO)5===E(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是________________。
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞如图所示。
体心立方晶胞和面心立方晶胞中E原子的配位数之比为________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com