
| A、F2 | B、Cl2 | C、Br2 | D、I2 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 卤族元素的单质与H2反应过程中的能量变化如图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).
卤族元素的单质与H2反应过程中的能量变化如图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).查看答案和解析>>
科目:高中化学 来源: 题型:
 卤族元素的单质和化合物很多.
卤族元素的单质和化合物很多.查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省咸阳市高考模拟考试(二)理综化学试卷(解析版) 题型:填空题
卤族元素的单质和化合物很多,请利用所学物质结构与性质的相关知识回答下列问题:
(1)卤族元素位于周期表的 ????????? 区;氟原子的电子排布图为?????? 溴原子的价电子排布式为????? .
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是??????????
(3)已知高碘酸有两种形式,化学式分别为H5IO6 和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6??????????? HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为???????????? 。
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6??????????? HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为???????????? 。
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大。这是由于溶液中发生下列反应 I-+ I2 =I3-与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 ??? 式发生。
A.CsICl2=CsCl+ICl?????? B.CsICl2 =CsI +Cl2
(5)ClO2-的空间构型为?????? 型,中心氯原子的杂化轨道类型为???????? ,写出一个ClO2-的等电子体 ???????????? 。
(6)如图为碘晶体晶胞结构。有关说法中正确的是???? 。

A.碘分子的排列有2种不同的取向
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
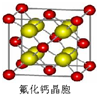
(7)已知CaF2晶体(见图)的密度为ρg/cm3 .NA为阿伏加德罗常数,相邻的两个Ca2+核间距为a cm,则CaF2的摩尔质量可以表示为?????? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com