
| A、钠与水反应:Na+H2O═Na++OH-+H2↑ |
| B、用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O |
| C、AlCl3溶液中加入过量的浓氨水:Al3++3OH-═Al(OH)3↓ |
| D、Ba(OH)2溶液与H2SO4溶液混合:Ba2++SO42-+OH-+H+═BaSO4↓+H2O |


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2S水溶液在空气中变浑浊 |
| B、生活中使用明矾净水,除去水中的悬浮颗粒 |
| C、溶有二氧化氮的浓硝酸做火箭的助燃剂 |
| D、漂白粉漂白有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A、X元素在周期表中的位置是第三周期第Ⅱ族 |
| B、X和W能形成离子化合物 |
| C、Y的最高价氧化物对应的水化物能溶于稀氨水 |
| D、Z的氢化物的稳定性比W的氢化物的稳定性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸性氧化物 | 电解质 | 高分子化合物 | |
| A | NO2 | 纯碱 | 葡萄糖 |
| B | 石英 | 氨水 | 淀粉 |
| C | Mn2O7 | H2O | 锦纶 |
| D | 醋酸酐 | HCl | 油脂 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
| B、CH2=CH2+Cl2+Ca(OH)2→CH2-CH2+CaCl2+H2O |
C、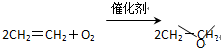 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na与水反应时增大水的用量 |
| B、将铝片改为铝粉,做铝与氧气反应的实验 |
| C、在K2SO4与BaCl2两溶液反应时,增大压强 |
| D、Fe与稀硫酸反应制取氢气时,改用浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com