
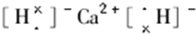 ,
,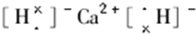 ;
;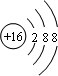 ,
, ;S=C=S;H2S;
;S=C=S;H2S;

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
| 100mL稀盐酸 |
| NaOH溶液 |
| 100mLNaOH溶液 |
| 稀盐酸 |
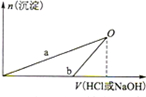 下列说法正确的是( )
下列说法正确的是( )| A、X溶液和Y溶液中均只含一种溶质 |
| B、b曲线表示的是向X溶液中加入NaOH溶液 |
| C、在O点时两方案中所得溶液浓度相等 |
| D、a、b曲线表示的反应都是复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3-C*H2-CH3 |
| B、C*H2=CH-CH3 |
| C、CH2=C*H-CH3 |
| D、CH2=CH-C*H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 水质分类 项目及标准 | I类 | II类 | III类 | IV类 | V类 |
| 磷(P)≤ | 0.02 | 0.1 | 0.2 | 0.3 | 0.4 |
| 氮(N)≤ | 0.2 | 0.5 | 1.0 | 1.5 | 2.0 |
| 锌(Zn)≤ | 0.05 | 1.0 | 1.0 | 2.0 | 2.0 |
| 铅(Pb)≤ | 0.01 | 0.01 | 0.05 | 0.05 | 0.1 |
| pH | 6~9 | 6~9 | 6~9 | 6~9 | 6~9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com