
【题目】下列指定反应的离子方程式正确的是( )
A. 将铜插入稀硝酸中:Cu+4H++2NO3–===Cu2++2NO2↑+H2O
B. 向碳酸氢铵溶液中加入足量澄清石灰水:Ca2++![]() +OH–
+OH–![]() CaCO3↓+H2O
CaCO3↓+H2O
C. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
D. 向Na2SiO3溶液中滴加稀醋酸:Na2SiO3+2H+===H2SiO3↓+2Na+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化合物(NH4)xFey(SO4)m是一种重要的化工原料。某实验小组为探究该物质的组成,进行如下实验:
(1)探究铁元素化合价
A.甲同学认为铁可能只有+3价;
B.乙同学认为铁可能只有+2价;
C.丙同学认为铁的化合价________________________________。
请设计实验,证明丙同学的结论:______________________________________。
(2)三位同学通过实验证明,铁的化合价为+2价。为了进一步探究该化合物的组成,设计了如下实验:
①准确称取4.36g样品,配制成100.00mL溶液A;
②准确量取20.00mL溶液A,用0.0200 mol·L-1的酸性KMnO4标准溶液滴定其中的Fe2+离子,消耗标准溶液的体积为40.00 mL;
③测定NH4+的含量;另取20.00mL溶液A,加入足量的NaOH溶液并充分加热,用100mL0.10 mol/L的稀盐酸吸收,再用0.10mol/LNaOH标准溶液滴定吸收液,消耗NaOH的体积为60mL。
Ⅰ.写出步骤②中发生的离子方程式__________________________________。
Ⅱ.步骤③中,加入NaOH溶液发生的化学反应方程式______________________________;加入的指示剂是_____________________,判断滴定终点的现象为_____________________,若滴定管在使用前未用NaOH标准溶液润洗,测得的NH4+含量将_____________(填“偏高”、“偏低”或“不变”)。Ⅲ. (NH4)xFey(SO4)m的化学简式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.镓(Ga)位于周期表的第四周期,与Al同主族,主要存在Ga3+、GaO2-两种离子形式,被广泛应用于电子工业。
(1)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有__________________。
a.KClO3 b. KCl c. MnO2 d. Mg
(2)半导体材料氮化镓由Ga与NH3在一定条件下发生置换反应生成。该过程每生成1molGaN(s)放出热量15.4kJ。镓在周期表中的序号_____________,写出该反应的热化学方程式_________________。
(3)工业上用电解法精炼镓。具体原理如图所示,已知:金属的活动性Zn>Ga>Fe>Cu

①电解精炼镓一段时间后形成的阳极泥主要有______________
②已知精炼时阴极反应:GaO2-+3e-+2H2O=Ga+4OH- 。阳极的电极反应方程式:___________________________________;
Ⅱ.用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

(4)步骤I温度不能过高。因为:_______________________________。
(5)步骤II中发生反应4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,生成的硝酸又将废铁皮中的铁转化为Fe(NO3)2。
写出后者反应的离子方程式______________________________________。
(6)上述生产流程中,能体现“绿色化学”思想的是______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
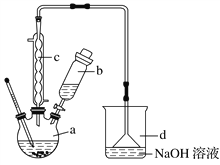
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体;继续滴加至液溴滴完;装置d的作用是________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_______________________________________________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是____________________________________________ 。
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中可行的是________(填字母)。
A.重结晶 B.过滤
C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填字母)。
A.25 mL B.50 mL
C.250 mL D.500 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列四个图象的说法中不正确的是
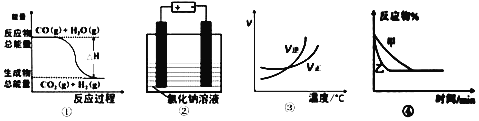
A. 图①可表示可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
B. 图②表示用惰性电极电解足量氯化钠溶液时,两极产生的气体物质的量相等
C. 图③可表示可逆反应:A2(g)+3B2(g)![]() 2AB3(g) ΔH >0
2AB3(g) ΔH >0
D. 图④可表示压强对可逆反应:2A(g)+B(g)![]() 3C(g)+D(s)的影响,且乙压强大
3C(g)+D(s)的影响,且乙压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是一种临床常用的基本药物,有广泛的用途,其合成路线如下:
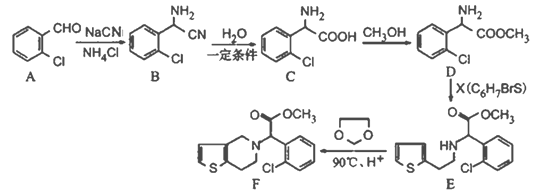
(1)写出B的分子式________________;C中碱性官能团的名称为____________________。
(2)写出与A含有相同官能团,属于芳香族化合物;且含有3种不同化学环境氢原子的同分异构体的结构简式__________________________________。
(3)C→D的反应类型是______________;X的结构简式为______________________。
(4)两个C分子可在一定条件下反应生成一种产物,该产物分子中含有3个六元环,写出该反应的化学方程式____________________________________。
(5)已知: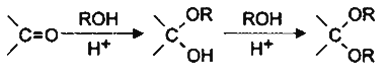
I.则由乙醇、甲醇为有机原料制备化合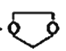 物,不需要经历下列的反应类型有____(填写编号)。
物,不需要经历下列的反应类型有____(填写编号)。
①加成反应,②消去反应,③取代反应,④氧化反应,⑤还原反应。
II.写出制备化合物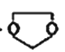 的最后一步反应的化学方程式________________________。
的最后一步反应的化学方程式________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com