
【题目】四种常见元素的性质或结构信息如F表所示,请问答下列问题。
元素 | A | B | R | D |
相关信息 | 基态原子核外电子占据3个能级且最高能级上有3个电子 | B的单质是最常见半导体材料 | 位于第四周期IB族 | 是非金属元素,其形成的某种单质是电的良导体,有的分子形状似足球 |
(1)R的基态原子价层电子排布式为________,这四种元素的第一电离能由大到小的顺序为________________(写元素符号)。
(2)A、B,D均可形成多种氢化物,在最常见的三种氢化物中,分子构型为三角锥的氢化物分子式为_______,任意写出一种中心原子存在sp2、sp3两种杂化类型的物质的结构简式________,与A的常见单质互为等电子体的上述元素的氧化物是________。
(3)B、D均可形成氧化物,等物质的量的B、D的最高价氧化物中σ键之比为________,已知有下列两种数据:
键能(kJ/mol) | 熔点(K) | 沸点(K)) | |
BO2 | B-O:452 | 1923 | 2503 |
DO2 | D=O:615,D-O:348 | 216 | 195 |
请解释键能大小与两种氧化物熔点、沸点高低差异过大的原因________。
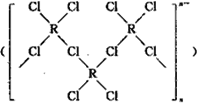
(4)在一定条件下,Cl-与R2+可形成一种无限长链离子,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氧与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为________。
(5)A元素能形成组成为Pt(AH3)2Cl2的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
①Q是________(填“极性”或“非极性”)分子,
②P的结构简式为________(AH3配体作为一个整体写)。
【答案】3d104s1 N>C>Si>Cu NH3 CH2=CH-CH3 CO 2:1 二氧化碳是分子晶体,熔点沸点高低是由比较微弱的范德华力决定的,而与化学键强弱无关,二氧化硅属于原子晶体,其熔点沸点高低是由强大的共价键决定的 (CuCl3)nn- 非极性 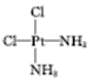
【解析】
A元素:基态原子核外电子占据3个能级,且最高能级上有3个电子,电子排布式为1s22s22p3,即A元素为N;B元素:B的单质是最常见半导体材料,即B为Si;R元素:位于第四周期IB族,即R为Cu;D元素:非金属元素,其形成的某种单质是电的良导体,这种单质为石墨,有的分子状似足球,即足球烯,推出D为C;
A元素:基态原子核外电子占据3个能级,且最高能级上有3个电子,电子排布式为1s22s22p3,即A元素为N;B元素:B的单质是最常见半导体材料,即B为Si;R元素:位于第四周期IB族,即R为Cu;D元素:非金属元素,其形成的某种单质是电的良导体,这种单质为石墨,有的分子状似足球,即足球烯,推出D为C;
(1)根据上述分析,R元素为Cu,价层电子包括最外层和次外层d能级,Cu元素价层电子排布式为3d104s1;元素非金属性越强,其第一电离能越大,即第一电离能大小顺序是N>C>Si>Cu;
(2)N、Si、C形成最常见的氢化物分别是NH3、SiH4、CH4,空间构型分别为三角锥形、正四面体、正四面体,因此分子构型为三角锥的氢化物分子式为NH3;甲烷中C原子sp3,碳碳双键中C原子杂化类型为sp2,即最简单的此类有机物是丙烯,其结构简式为CH3CH=CH2;A的单质为N2,根据等电子体的定义,与N2互为等电子体的氧化物是CO;
(3)SiO2为原子晶体,每个硅原子形成4个σ键,CO2为分子晶体,CO2的结构式为O=C=O,成键原子之间只能形成一个σ键,因此等物质的量的B、D的最高价氧化物中σ键之比为4:2=2:1;BO2为SiO2,属于原子晶体,DO2为CO2,属于分子晶体,键能大小与两种氧化物熔点、沸点高低差异过大的原因是二氧化碳是分子晶体,熔、沸点高低是由比较微弱的范德华力决定的,而与化学键强弱无关,二氧化硅属于原子晶体,其熔、沸点高低是由强大的共价键决定的;
(4)由图知,每个Cu2+单独结合两个Cl-,又与另外一个Cu2+共用两个Cl-,根据均摊方法,长链中n(Cu2+):n(Cl-)=1:3,化学式为(CuCl3)nn-;
(5)①Pt(AH3)2Cl2为Pt(NH3)2Cl2,根据相似相溶原理,淡黄色在水中的溶解度小,水为极性分析,即淡黄色为非极性分子;
②根据信息,Pt(NH3)2Cl2有两种结构,Pt(NH3)2Cl2为平面正方形结构,P在水中溶解度大,即P为极性分子,即结构简式为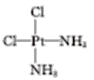 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图曲线 a 表示放热反应X(g)+Y(g) ![]() Z(g) + M(g) + N(s)进行过程中 X 的转化率随时间变化的关系。若要改变起始条件,使反应过程按 b 曲线进行,可采取的措施是( )
Z(g) + M(g) + N(s)进行过程中 X 的转化率随时间变化的关系。若要改变起始条件,使反应过程按 b 曲线进行,可采取的措施是( )
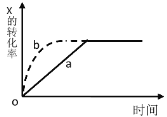
A.升高温度B.加大 X 的投入量
C.加催化剂D.增大体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组查阅资料知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应。他们设计了制取并验证产物的装置,如下图所示。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中。如图是制取溴苯的装置。试回答:

(1)装置A中发生反应的化学方程式是___________。
(2)装置C中看到的现象是___________,证明___________。
(3)装置B是吸收瓶,内盛CCl4液体,实验中观察到的现象是___________,原因是___________。如果没有B装置而将A、C直接相连,你认为是否妥当?___________(填“是”或“否”),理由是___________。
(4)实验结束后,经过下列步骤分离提纯:
①向A中加入适量蒸馏水,过滤,除去未反应的铁屑;
②滤液依次用蒸馏水、10%的NaOH溶液、蒸馏水洗涤后静止分液。
NaOH溶液洗涤的作用是___________,分液时获得有机层的具体操作是___________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的目的是___________;
(5)经以上分离操作后,粗溴苯中还含有的主要杂质为___________,要进一步提纯,下列操作中必须的是___________(填入正确选项前的字母);
A.结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol甲烷与一定量的氯气混合于一量筒中,倒立于盛有饱和食盐水的水槽(如图所示),对于此反应,有关叙述不正确的是( )

A.该反应的有机生成物有四种,都为液体B.该反应的条件是光照,但是不能放在日光直射的地方
C.该反应属于取代反应D.该反应现象有量筒内气体颜色变浅,器壁上有油状液滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素原子的下列结构或性质,能确定其在周期表中位置的是( )
A. 某元素原子的第二电子层电子排布图为![]()
B. 某元素在某种化合物中的化合价为+4
C. 某元素的原子最外层上电子数为6
D. 某元素的外围电子排布式为5s25p1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000mol/LNaOH溶液分别滴定20.00mL0.1000mol/LHCl和20mL0.1000mol/LCH3COOH,得到如图所示两条滴定曲线,下列说法不正确的是( )
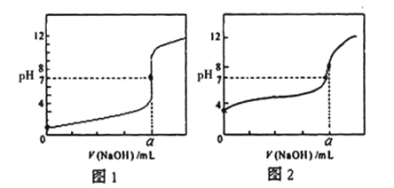
A.图1表示NaOH滴定盐酸的曲线
B.a=20mL
C.图2中,pH=7,c(CH3COO-)=c(Na+)
D.图1中,由水电离的c(H+)一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红矾钠(重铬酸钠:![]() )是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
)是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
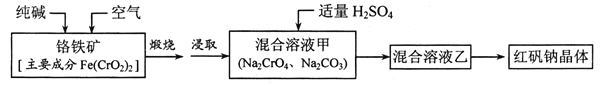
请回答下列问题:
(1)![]() 的基态电子排布式为____________。
的基态电子排布式为____________。
(2)锻烧铬铁矿发生反应:____________![]() 配平上述化学反应方程式。
配平上述化学反应方程式。
(3)溶液甲中加入H2SO4时,可以观察到溶液由黄色变为橙色,并放出无色气体,有 关反应的离子方程式为____________。
(4)制备红矾钠的废水必须进行处理。首先酸化废水,将含+6价铬的酸性废液放入电解槽内,用铁作阳极进行电解,阴极析出H2,阳极产物被![]() 氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
①阳极的电极反应式为(不考虑后续反应):____________。
②溶液中金属离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因:______。
③已知某含![]() 的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源,海水综合利用的流程图如下:

(一)某化学研究小组用如图装置模拟步骤I电解食盐水(用铁和石墨做电极)。

(1)a电极材料是_____(填铁、石墨),其电极反应式为_________。
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为______(忽略反应前后溶液体积的变化)。
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+。
下表是生成氢氧化物沉淀的pH:
物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,可选用的物质是_____(填序号,下同),加入_____调节溶液的pH,充分反应后过滤,可得MgCl2溶液。
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2·H2O获得MgCl2的操作是:_________。
(三)制取工业溴:
(5)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是_______。
(6)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C3H7Br 的有机物甲在适宜的条件下能发生如下一系列转化:
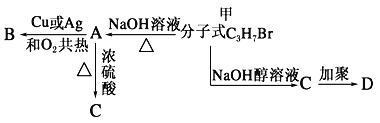
(1)若B能发生银镜反应,试回答下列问题:
①试确定有机物甲的结构简式:___________;
②用化学方程式表示下列转化过程:甲+ NaOH:___________________B+Ag(NH3)2OH:_________________
(2)若B不能发生银镜反应,请回答下列问题:
①试确定A的结构简式______________;
②用化学方程式表示下列转化过程:甲+NaOH![]() ____________________A→B:_____________________C→D:_____________________
____________________A→B:_____________________C→D:_____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com