
| 序号 | 物质 | 杂质 | 试剂 | 方法 |
| A | CH3CH2OH | H2O | CaO | 蒸馏 |
| B | CH3COOC2H5 | CH3COOH | CH3CH2OH、浓H2SO4 | 加热 |
| C | 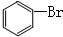 |
Br2 | NaOH溶液 | 振荡、静置、分液 |
| D | CH3CH2OH | CH3COOH | NaOH | 蒸馏 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:陕西省模拟题 题型:填空题
查看答案和解析>>
科目:高中化学 来源:陕西省模拟题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
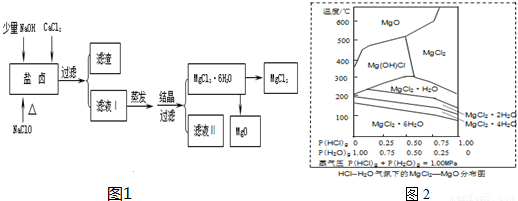
广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+、SO42-和CO(NH2)2等。制备流程如下图:
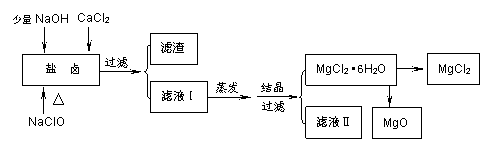
(1)滤渣的成分是 (写化学式);滤液Ⅱ中所含主要的杂质离子是 (写离子符号)。
(2)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为 ;加入NaClO的另一个作用是 。
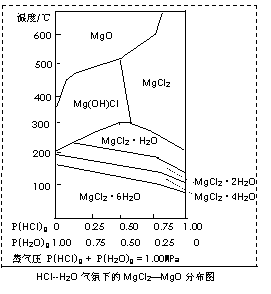
(3)温度和压强P(HCl)g对MgCl2?6H2O晶体热分解产物的影响如图所示。请回答下列问题:
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式 ;
②实际生产中,将MgCl2?6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是 ;若要得到无水MgCl2须采取的措施是 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省温州市八校联考高三(上)期末化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com