
| A | |||||||||||||||||
| D | E | ||||||||||||||||
| G | Q | M | R | ||||||||||||||
| T | |||||||||||||||||
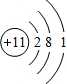 ;
;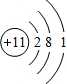 ;S 2->Cl-;
;S 2->Cl-;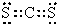 ;
;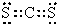 ;c、d;
;c、d;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| a | |||||||||||||||||
| b | c | d | |||||||||||||||
| e | f | g | h | i | |||||||||||||
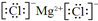
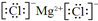
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2010年长沙市一中学业水平模拟测试卷(三)化学卷 题型:填空题
下面是元素周期表的一部分,表中的每个字母表示一种短周期元素,请回答下列问题:
| | | | | |||||
| | | | | | | | A | |
| B | C | | | D | | | E | |
查看答案和解析>>
科目:高中化学 来源:2012届福建省高二下学期学段考试化学试卷(解析版) 题型:填空题
(7分)元素周期表是学习物质结构和性质的重要工具,下面是元素周期表的一部分,表中所列字母A、D、E、G、Q、M、R、T分别代表某一化学元素。请用所给元素回答下列问题。
|
A |
|
|
|||||||||||||||
|
|
|
|
|
D |
E |
|
|
|
|||||||||
|
G |
|
|
Q |
|
M |
R |
|
||||||||||
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
(1)某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为 。
 (2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)
。
(2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)
。
(3)M、D两种元素形成的化合物含有的化学键类型是 ,其分子是(填“极性”或“非极性”) 分子;
A分别与D、E、R形成的分子中,分子间存在氢键的是(填分子式) 。
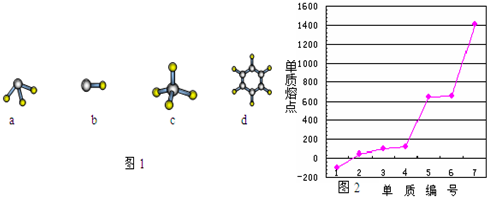
A与D形成分子的空间结构可能是(填序号) 。(2分)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com