
����Ŀ����A��B��C��D��E 5��Ԫ�أ����ǵĺ˵�������������Ҷ�С��20������C��E�ǽ���Ԫ�أ�A��E��ͬһ�壬����ԭ�ӵ����������Ų�Ϊns1 �� B��DҲ��ͬһ�壬����ԭ��������p�ܼ���������s�ܼ���������������Cԭ��������ϵ���������Dԭ��������ϵ�������һ�룮��ش��������⣺
��1��A�� �� B�� �� C�� �� D�� �� E�� �� ��дԪ�ط��ţ�
��2����������Ԫ����ɵ�һ�ֻ������ǣ�д��ѧʽ�� �� д�������ʵ�һ����Ҫ��;�� ��
��3���ù����ʾʽ��ʾDԪ��ԭ�ӵļ۵��ӹ��� ��
��4��Ԫ��B��D�ĵ縺�ԵĴ�С��ϵ�� �� C��E�ĵ�һ�����ܵĴ�С��ϵ�� �� �������������
���𰸡�
��1��H��O��Al��S��K
��2��KAl��SO4��2?12H2O����ˮ��
��3��![]()
��4��O��S��Al��K
���������⣺A��B��C��D��E 5��Ԫ�أ����ǵĺ˵�������������Ҷ�С��20��B��DҲ��ͬһ�壬����ԭ��������p�ܼ���������s�ܼ��������������������������Ų�Ϊns2np4 �� ��BΪOԪ�أ�DΪSԪ�أ�A��EԪ��ԭ�ӵ����������Ų�Ϊns1 �� ���ڵڢ�A�壬EΪ������E��ԭ����������SԪ�أ���AΪHԪ�أ�EΪKԪ�أ�Cԭ��������ϵ���������Dԭ��������ϵ�������һ�룬��Cԭ������������Ϊ3��ԭ����������O��S֮�䣬��CΪAlԪ�أ���1�������Ϸ�����֪AΪH��BΪO��CΪAl��DΪS��EΪK�����Դ��ǣ�H��O��Al��S��K����2����������Ԫ����ɵ�һ�ֻ���������������ѧʽΪKAl��SO4��212H2O����Ҫ��;�Ǿ�ˮ�������Դ��ǣ�KAl��SO4��212H2O����ˮ������3��DΪSԪ�أ�ԭ�Ӽ۲�����Ų�Ϊns2np4 �� �����ʾʽΪ�� 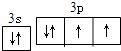 �����Դ��ǣ�
�����Դ��ǣ� 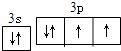 ����4��ͬ�������϶��µ縺�Խ��ͣ��ʵ縺��O��S��������Խǿ����һ������ԽС���ʵ�һ������Al��K�����Դ��ǣ�O��S��Al��K��
����4��ͬ�������϶��µ縺�Խ��ͣ��ʵ縺��O��S��������Խǿ����һ������ԽС���ʵ�һ������Al��K�����Դ��ǣ�O��S��Al��K��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������㷺��Ӧ���ڴ������¿�ѧ�У�������������ָ����ֱ���ڼ�������ʮ���IJ��ϡ��罫�����ײ�������ɢ��Һ���ɢ���У����õĻ������е������ǣ� ��
A.��ȫ��ͨ����ĤB.�ܷ������������C.һ���ܵ���D.һ��Ϊ����Һ������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
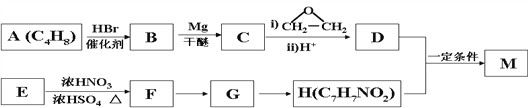
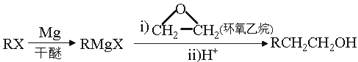
����Ŀ���Ա�ϩΪԭ�Ϻϳɿ���ҩ��D�ͻ���������ǿ�Ƽ���ĺϳ�·������(���ַ�Ӧ�����Ͳ��Z����ȥ)��
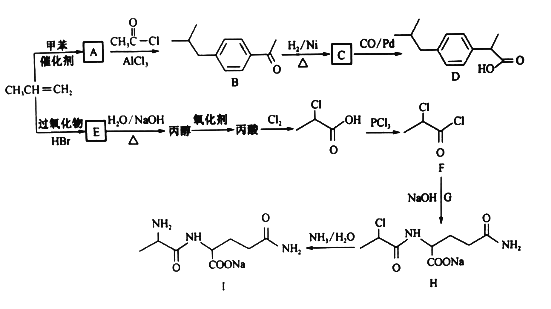
��֪�� +HCl
+HCl
�ش��������⣺
��1��A�Ľṹ��ʽ________����H����I�ķ�Ӧ����Ϊ______________��
��2��E������Ϊ_____________��
��3��������G�Ļ�ѧʽΪC5H10O3N2������ṹ��ʽΪ___________________��
��4����E���ɱ�ϩ�Ļ�ѧ����ʽΪ __________________________________��
��5������ʽΪC9H10O2���л���J��D��ͬϵ�J�Ľṹ����________�֡�
��6��������������е���Ϣ��������� �Ʊ�
�Ʊ�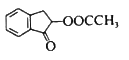 �ĺϳ�·�ߣ�_________________���������Լ���ѡ��
�ĺϳ�·�ߣ�_________________���������Լ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����Ȼ��ͭ����Ҫ�ɷ�ΪCuFeS2 ����SiO2����Ϊ�˲ⶨ�û�ͭ��Ĵ��ȣ�ijͬѧ�������ͼ1ʵ�飺

��ȡ��ϸ�Ļ�ͭ����Ʒ1.150g���գ�����Cu��Fe2O3 ��FeO��SO2���壬ʵ���ȡd����Һ��1/5������ƿ�У���0.01mo1/L������Һ���еζ���������Ϊ0.10mL��ĩ������ͼ2��ʾ�����������գ�
��1��װ��c��������____________________________��
��2��������Ӧ����������ͨһ��ʱ��Ŀ�������Ŀ����_____________________��
��3���ζ�ʱ��������Һ�������Ϊ_____mL���û�ѧ����ʽ��ʾ�ζ���ԭ����________________________________________��
��4������û�ͭ��Ĵ���___________________��
��5����ҵ�����û�ͭ��ұ��ͭ������¯������Fe2O3 ��FeO��SiO2��Al2O3�����Ʊ�Fe2O3��
ѡ���ṩ���Լ������ʵ����֤¯���к���FeO��
�ṩ���Լ���ϡ���� ϡ���� KSCN��Һ KMnO4��Һ NaOH��Һ
��ѡ�Լ�Ϊ_________��֤��¯���к���FeO��ʵ������Ϊ��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I. �����£��ֱ���2 mL ��0.1 mol/L HCl��0.1 mol/L CH3COOH��Һ��Ͷ������þ����
��1����Ӧǰ����Һ��pH��pH(����) _______ pH(����)��ѡ����>������<������=��������2����ͬ����
��2����ʼʱ��þ����Ӧ�����ʣ�v(����) ________v(����)��
��3�������������������ʵ���������________������
��4����Ӧǰ������c(OH-)=_________mol/L��
II. �ֱ���2 mL ������Ũ����Ϊ0.1 mol/L�������������Һ��Ͷ��������þ����
��5����ʼʱ��þ����Ӧ�����ʣ�v(����)_____v(����)��ѡ������>������<������=��������2����ͬ����
��6����������ʼ�����ʵ���Ũ�ȣ�c(����) ______c(����)��
��7���������������ĵ����ʵ���������______������
III. ��֪������H3PO2��һԪ���ᣬ20�� ʱ�ĵ��볣��K �� 0.1��
��8��д�����ĵ��뷽��ʽ______________________________��
��9��д��K�ı���ʽ��K=________, 0�� ʱ��0.2 mol/L H3PO2��Һ��pH =_____��ƽ��ʱc(H3PO2)�������ƴ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и߷��Ӳ��ϲ���ֱ�ӽӴ�ʳƷ���ǣ� ��
A.�۱�ϩB.����ϩC.������ϩD.�۶Ա��������Ҷ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�������һ��2L���ܱ�������������4 molA��2molB�������·�Ӧ��
3A(g)+2B(g)![]() 4C(s)+D(g)����Ӧ2 min��ﵽƽ�����������1.6 mol C������˵����ȷ����( )
4C(s)+D(g)����Ӧ2 min��ﵽƽ�����������1.6 mol C������˵����ȷ����( )
A. ǰ2min��D��ƽ����Ӧ����Ϊ0.2mol/(L��min)
B. ��ʱ��B��ƽ��ת������40��
C. ����B��ƽ�������ƶ���B��ƽ��ת��������
D. �������ϵ��ѹǿ��ƽ�ⲻ�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ı���Һ�ζ������������Ƶ�Ũ��ʱ���ü�����ָʾ�����ﵽ�ζ��յ�ʱ����Һ����ɫ�仯��( )
A.�ɺ�ɫ��Ϊ��ɫB.����ɫ��Ϊdz��ɫ
C.�ɻ�ɫ��Ϊ��ɫD.�ɺ�ɫ��Ϊdz��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������һ��ֲ�����ҩ��������M�Ǹ���ҩ��֮һ���ϳ�M��һ��·�����£�
��֪������Ϣ��
�ٺ˴Ź���������ʾBֻ��һ�ֻ�ѧ�������⣬H�����������ֻ�ѧ�������⡣
�� ��
��
��EΪ������������Է�������Ϊ92����![]() ���������ױ���������
���������ױ���������
�ش��������⣺
��1��A�Ľṹ��ʽΪ_________________���仯ѧ������__________��
��2����E����F�Ļ�ѧ����ʽΪ__________________��
��3����G����H�ķ�Ӧ����Ϊ__________________��
��4��M�Ľṹ��ʽΪ________________________________��
��5��D��ͬ���칹���в���������Ʒ�Ӧ���������Ĺ���_________�֣������������칹�������к˴Ź�������ֻ������壬�ҷ������Ϊ6:1����_________________��
��6�����������ϳ�·�ߣ�����ϩ�ͻ�������Ϊԭ��(���Լ���ѡ)�Ʊ�1��6������ȩ����ƺϳ�·�� ___________________________________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com