
下列溶液中微粒的物质的量浓度关系一定正确的是
A.pH=9的NaHA溶液:c(Na+)>c(HA-)>c(A2-)>c(H2A)
B.Na2CO3溶液:c(H+)-c(OH-) = c(HCO3-) +2c(CO32-)-c(Na+)
C.稀盐酸中加入一定量氨水后溶液显碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.将0.1mol·L-1 HF溶液与0.1mol·L-1 KF溶液等体积混合:c(F-)+c(HF)=0.2mol·L-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列叙述正确的是( )
A. 等物质的量的氢氧根离子(OH-)与甲基(-CH3)所含电子数相等
B. 铁、Cu、稀硫酸组成的原电池,当金属铁质量减轻5.6 g时,产生H22.24L
C.16 g甲烷分子中含有共价键数目共为4NA
D.2.8 g乙烯与丙烯的混合物中含碳原子的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ (1)用浓硫酸配制250mL2mol∙L-1硫酸溶液时,所需的玻璃仪器除烧杯、玻璃棒和胶头滴管之外,还需要 (填仪器名称);在下列配制过程示意图中,有错误的是(填写序号) 。
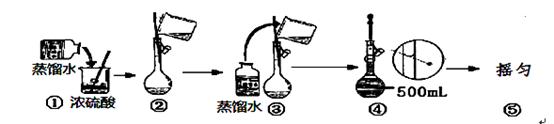
 (2)现要用容量瓶配制500mL0.4mol∙L-1Na2CO3溶液,配好的溶液倒入试
(2)现要用容量瓶配制500mL0.4mol∙L-1Na2CO3溶液,配好的溶液倒入试
剂瓶后需要贴上标签。请你帮助把右图标签上的内容填上去。
(3)下列情况将使配制溶液的物质的量浓度偏低的有 (填序号)
A. 容量瓶用蒸馏水洗净后,未待干燥便用来配制
B. NaOH溶解后趁热移入容量瓶中
C. 定容时,俯视刻度线 D. 摇匀后发现液面未到刻度线,继续加水至刻度线
 Ⅱ 某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下
Ⅱ 某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下
图所示装置制取NaHCO3,反应的化学方程式为NH3+CO2+H2O+NaCl = NaHCO3↓+NH4Cl。
然后再将NaHCO3制成Na2CO3。
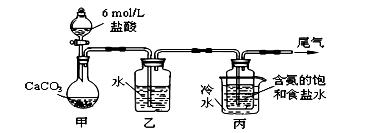
⑴ 装置乙的作用是 。为防止污染空
气,尾气中含有的 需要进行吸收处理。
⑵由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有 、
、 。NaHCO3转化为Na2CO3的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在氯化铵溶液中,下列关系式正确的是:
A.[Cl-]>[NH4+]>[H+]>[OH-] B.[NH4+]>[Cl-]>[H+]>[OH-]
C.[Cl-]=[NH4+]>[H+]=[OH-] D.[NH4+]=[Cl-]>[H+]>[OH-]
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)= 0时,c(H+)= 1 × 10-2 mol/L
B.V(NaOH)< 10 mL时,不可能存在c(Na+)= 2 c(C2O )+ c(HC2O
)+ c(HC2O )
)
C.V(NaOH)= 10 mL时,c(H+)= 1 × 10-7mol/L
D.V(NaOH)> 10 mL时,c(Na+)> c(C2O )>c(HC2O
)>c(HC2O )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作_____剂。
 (2)自然界Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。完成并配平下列离子方程式:
(2)自然界Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。完成并配平下列离子方程式:
 __Cr2O72-+__SO32-+__ =__Cr3++__SO42-+ __H2O
__Cr2O72-+__SO32-+__ =__Cr3++__SO42-+ __H2O
(3)某锂离子电池用含有Li+的导电固体作为电解质。充电时,Li+还原为Li,并以原子形式嵌入电极材料C6中,以LiC6表示,电池反应为CoO2+LiC6  LiCoO2+C6。放电时的正极反应式为___________。右图表示该装置工作时电子和离子的移动方向,此时C6电极作____极。
LiCoO2+C6。放电时的正极反应式为___________。右图表示该装置工作时电子和离子的移动方向,此时C6电极作____极。
(4)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ•mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160kJ•mol-1
甲烷直接将NO2还原为N2的热化学方程式为 _________________________________ 。
(5)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:


①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__________。
②对滤液Ⅱ调pH的目的是除去Fe3+,其原理是Fe3++3H2O Fe(OH)3+3H+,已知25℃时Ksp[Fe(OH)3]=2.8×10-39,则该温度下上述反应的平衡常数K= 。
Fe(OH)3+3H+,已知25℃时Ksp[Fe(OH)3]=2.8×10-39,则该温度下上述反应的平衡常数K= 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,化学键的类型相同的是 ( )
A. HCl、MgCl2、NH4Cl B. H2O、Na2O、CO2
C. CaCl2、NaOH、H2O D. NH3、H2O、CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
为提纯下列物质(括号内为少量杂质),所选用的除杂式试剂和分离方法正确的是( )
| 提纯物质 | 除杂试剂 | 分离法 | |
| A | KCl溶液(FeCl3) | 氨水 | 过滤 |
| B | 乙酸乙酯(乙酸) | 乙醇和浓硫酸 | 分液 |
| C | Fe粉(Al粉) | NaOH溶液 | 过滤 |
| D | 乙醇(H2O) | 金属钠 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在一定条件下, 2SO2+O2 2SO3 反应达平衡后SO2的转化率为45.3%,加入V2O5(催化剂)后,SO2的转化率为
2SO3 反应达平衡后SO2的转化率为45.3%,加入V2O5(催化剂)后,SO2的转化率为
A. 大于45.3% B. 小于45.3% C. 等于45.3% D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com