
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)= 0时,c(H+)= 1 × 10-2 mol/L
B.V(NaOH)< 10 mL时,不可能存在c(Na+)= 2 c(C2O )+ c(HC2O
)+ c(HC2O )
)
C.V(NaOH)= 10 mL时,c(H+)= 1 × 10-7mol/L
D.V(NaOH)> 10 mL时,c(Na+)> c(C2O )>c(HC2O
)>c(HC2O )
)
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
(1)生产中为提高反应速率和SO2的转化率,下列措施可行是 。
A.向装置中充入O2 B.升高温度
C.向装置中充入N2 D.向装置中充入过量的SO2
(2)恒温恒压,通入3mol SO2 和2mol O2 及固体催化剂,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g),下列说法正确的是
 A.第一次平衡时反应放出的热量为294.9kJ
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
(3)500 ℃时将10 mol SO2和5.0 mol O2置于体积为1L的恒容密闭容器中,SO2转化为SO3的平衡转化率为0.95。则500℃时的平衡常数K= 。
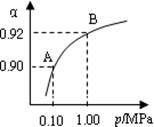
(4)550 ℃,A、B表示不同压强下的平衡转化率(如图),
通常工业生产中采用常压的原因是 ,
并比较不同压强下的平衡常数:K(0.10 MPa) K(1.0 MPa)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除去杂质的方法正确的是( )
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | NaHCO3固体 | Na2CO3固体 | / | 加热 |
| B | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| C | KBr溶液 | Br2 | KOH溶液 | 分液 |
| D | Cl2 | HCl | 饱和碳酸钠溶液 | 洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
熔融状态下,Na的单质和FeCl2能组成可充电电池(装置示意图如下),反应原理为:
2Na+ FeCl2 Fe+ 2NaCl
Fe+ 2NaCl
放电时,电池的正极反应式为 ;充电时, (写物质名称)电极接电源的负极;该电池的电解质为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于0.1 mol•L-1 Na2SO3溶液,正确的是
A.升高温度,溶液的pH降低
B.c(Na+)=2c(SO32―)+ c(HSO3―)+ c(H2SO3)
C.c(Na+)+c(H+)=2c(SO32―)+2c(HSO3―)+c(OH―)
D.加入少量NaOH固体,c(SO32―)与c(Na+)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中微粒的物质的量浓度关系一定正确的是
A.pH=9的NaHA溶液:c(Na+)>c(HA-)>c(A2-)>c(H2A)
B.Na2CO3溶液:c(H+)-c(OH-) = c(HCO3-) +2c(CO32-)-c(Na+)
C.稀盐酸中加入一定量氨水后溶液显碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.将0.1mol·L-1 HF溶液与0.1mol·L-1 KF溶液等体积混合:c(F-)+c(HF)=0.2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
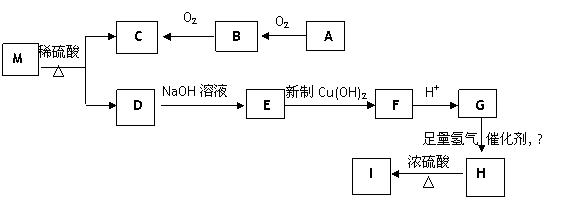 有机物M的分子式为C9H8O2Br2,有机物C的相对分子质量为60,有机物E的化学式为C7H5O2Na。G遇FeCl3溶液显紫色,H转化为I时产物只有一种结构且I能使溴的CCl4溶液褪色。各物质间有如图所示的转化关系
有机物M的分子式为C9H8O2Br2,有机物C的相对分子质量为60,有机物E的化学式为C7H5O2Na。G遇FeCl3溶液显紫色,H转化为I时产物只有一种结构且I能使溴的CCl4溶液褪色。各物质间有如图所示的转化关系
已知:两个羟基连在同一碳原子上的结构不稳定,会自动发生如下变化:
CH3CH(OH)2→CH3CHO+H2O。请回答下列问题:
(1)B中所含官能团的名称是 ,H→I的反应类型是 。
(2)I的结构简式是 。
(3)①M→C+D的化学方程式是 。
②E→F的化学方程式是 。
(4)H在一定条件下发生缩聚反应的化学方程式是 。
(5)有机物J在分子组成上比G多两个CH2基团,则同时符合下列条件的J的结构共有 种。
①能发生水解反应 ②能发生银镜反应 ③与FeCl3溶液反应显紫色
④分子中有4种不同的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
绿色化学中,最理想的“原子经济”是原子利用率为100%。下列反应类型能体现“原子经济性”原则的是 ( )
①取代反应 ②加成反应 ③酯化反应 ④水解反应 ⑤加聚反应
A. ②⑤ B. ①② C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为:
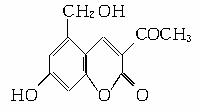 它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(1)“亮菌甲素”的分子式为________。
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其属于醇类的同分异构体的结构简式
___________________________________________________。
(3)下列有关“亮菌甲素”的叙述正确的是________(填字母)。
A.“亮菌甲素”能与H2发生加成反应
B.不能使酸性KMnO4溶液褪色
C.“亮菌甲素”分子中含氧官能团只有2种
D.1 mol“亮菌甲素”最多与3 mol NaOH反应
(4)核磁共振氢谱分析,发现二甘醇分子中有3个吸收峰,其峰面积之比为2∶2∶1。又知二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,1 mol二甘醇与足量金属钠反应生成1 mol H2。写出二甘醇与乙酸(按物质的量之比1∶1)反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com