
【题目】氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)形成酸雨的原理之一可简单表示如下:
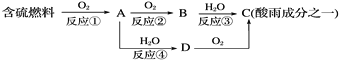
回答下列问题:
①酸雨的pH________(填“>”、“<”或“=”)5.6。
②D物质的化学式为____________。
③反应②的化学方程式为_________________________________________。
(2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:__________________,反应中氧化剂是____________,还原剂是_______________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O,2NO2+2NaOH===NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收n molNO2和m molNO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为________ mol·L1。
②若所得溶液中c(NO3—)∶c(NO2—)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=______。
③用含n和m的代数式表示所得溶液中NO3—和NO2—浓度的比值c(NO3—)∶c(NO2—)=________。
【答案】 < H2SO3 2SO2+O2![]() 2SO3 6NO2+8NH3
2SO3 6NO2+8NH3![]() 7N2+12H2O NO2 NH3
7N2+12H2O NO2 NH3 ![]() 3∶2
3∶2 ![]()
![]()
【解析】
由图示转化可知:A为SO2,B为SO3,C为H2SO4,D为H2SO3。
(1)酸雨的pH<5.6,正常雨水的pH=5.6;由分析可知D为H2SO3,A为SO2,B为SO3,反应方程式为:2SO2+O2![]() 2SO3,注意此反应是可逆反应,应用可逆符号连接;
2SO3,注意此反应是可逆反应,应用可逆符号连接;
(2)NH3和NO2发生氧化还原反应生成的无污染物质是N2和H2O,反应方程式为:6NO2+8NH3![]() 7N2+12H2O,反应中NO2中N的化合价由+4价降低到0价,得到电子,被还原,本身作氧化剂;NH3中的N由-3价上升到0价,失去电子,被氧化,本身作还原剂。
7N2+12H2O,反应中NO2中N的化合价由+4价降低到0价,得到电子,被还原,本身作氧化剂;NH3中的N由-3价上升到0价,失去电子,被氧化,本身作还原剂。
(3)①因产物NaNO3、NaNO2中n(Na+)=n(N),故n(NaOH)=n(NO)+n(NO2)=(m+n) mol,c(NaOH)= ![]() mol·L-1。②NO2与NO混合气体与NaOH溶液反应可以认为先后发生如下反应:
mol·L-1。②NO2与NO混合气体与NaOH溶液反应可以认为先后发生如下反应:
NO2+NO+2NaOH===2NaNO2+H2O
m m 2m 2m
2NO2+2NaOH===NaNO2+ NaNO3+H2O
n-m ![]() (n-m)
(n-m) ![]() (n-m)
(n-m)
当V(NO)2≥V(NO)时能吸收完全,所以c(NO3-)∶c(NO2-)=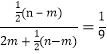 ,得n∶m=3∶2。③c(NO3-)∶c(NO2-)=
,得n∶m=3∶2。③c(NO3-)∶c(NO2-)= ![]() (n-m)∶[2m+
(n-m)∶[2m+ ![]() (n-m)]=
(n-m)]=![]() 。
。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】实验室中需要配制2mol/L的NaCl溶液920mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.920 mL,107.64 g
B.500 mL,117 g
C.1000 mL,117.0g
D.任意规格,107.64 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为_____。
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10 mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论_________________。
②同学们在两烧杯中还观察到以下现象。其中,属于盛放Na2CO3的烧杯中出现的现象的是______(填字母序号)。
a.溶液温度下降 b.溶液温度升高 c.滴入酚酞后呈浅红色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中。

①两试管中均产生气体,__________(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是__________。
a.装置Ⅰ的气球体积较大
b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算
d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象作出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2 mLNa2CO3溶液中滴加1mL 0.5mol·L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32—浓度较大,能与CaCl2发生反应______________(写离子方程式) |
操作2:向2 mLNaHCO3溶液中滴加1 mL 0.5mol·L-1CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32—浓度很小,不能与CaCl2反应 |
实际实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
(1)①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为________________。
②用CO、O2和固体电解质还可以制成如下图1所示的燃料电池,则电极d的电极反应式为______________。
(2)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图2所示。

①在图示2的转化中,化合价不变的元素是_________(填元素名称)。
②在转化过程中通入氧气发生反应后,溶液的pH将________(填“增大”、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为________。
③加入NaClO时发生的反应为:Cu(NH3)![]() +2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
+2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有________、________

图3
(3)CO与SO2在铝矾土作催化剂、773 K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。

(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是________;发生装置B应选择以下三种装置中的________(填序号)。

(2)D装置中主要反应的离子方程式为____________________________________________________。
(3)为验证通入D装置中的气体是Cl2过量还是SO2过量,兴趣小组的同学准备了以下试剂:
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④酸性高锰酸钾溶液
若Cl2过量,取适量D中溶液滴加至盛有________(填一个序号,下同)试剂的试管内,再加入________试剂。发生的现象是_____________________________________________。
若SO2过量,取适量D中溶液滴加至盛有________试剂的试管内,发生的现象是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置:

(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
接 , 接 , 接 ;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?
乙中 ____ ,丙中 ______ ;
(3)丁中酸性KMnO4溶液的作用是 ;
(4)写出甲中反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。其转化关系如图。

请回答:
(1)工业上制C用A不用H的原因 。
(2)写出C与K反应的化学方程式 ,该反应的反应物总能量 (填“大于”或“小于”)生成物总能量。
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式 。
(4)写出E物质的电子式 。
(5)J与H反应的离子方程式为 。
(6)写出G与熟石灰反应制取漂白粉的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】升高温度能加快反应速率的主要原因是 ( )
A. 活化分子能量明显增加 B. 降低活化分子能量 C. 增加活化分子百分数 D. 降低反应所需能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com