
����Ŀ��ijʵ��С����̽��Na2CO3��NaHCO3������,����ʵ������ʢ�����ֹ�����Լ�ƿ��ʧ�˱�ǩ������,�����ȶԹ���A��B���м���,��ͨ��ʵ���������̽����
(1)�ֱ���ȹ���A��B,���ֹ���A���Ȳ�����������ʹ����ʯ��ˮ����ǡ�A���ȷֽ�Ļ�ѧ����ʽΪ_____��
(2)��ȡ���ֹ����2g,�ֱ��������С�ձ���,�ٸ���10 mL����ˮ,��,�����¶ȱ仯�����������ܽ�,�ָ�������,��������Һ�и�����2�η�̪��Һ��
�ٷ���Na2CO3������ȫ�ܽ�,��NaHCO3������ʣ��,�ɴ˵ó�����_________________��
��ͬѧ�������ձ��л��۲쵽������������,����ʢ��Na2CO3���ձ��г��ֵ��������______(����ĸ���)��
a.��Һ�¶��½� b.��Һ�¶����� c.�����̪���dz��ɫ d.�����̪��ʺ�ɫ
(3)��ͼ��ʾ,�����������õ�װ�â�͢��зֱ����ҩƷ,�������ڵĹ���ͬʱ�����Թ��С�

�����Թ��о���������,__________(���)�ķ�Ӧ�̶ȸ�Ϊ���ҡ�
�ڷ�Ӧ������,�����������,�ָ�������,����˵����ȷ����__________��
a.װ�â����������ϴ�
b.װ�â����������ϴ�
c.�����������������������
d.���������������ݹ������
(4)ͬѧ�ǽ����ֹ���ֱ����Ƴ�0.5 mol��L-1����Һ,������·������Է�Ӧ��������Ԥ��:
ʵ�鷽�� | Ԥ������ | Ԥ������ |
����1:��2 mLNa2CO3��Һ�еμ�1mL 0.5mol��L-1CaCl2��Һ | �а�ɫ���� | Na2CO3��Һ�е�CO32��Ũ�Ƚϴ�,����CaCl2������Ӧ______________(д���ӷ���ʽ) |
����2:��2 mLNaHCO3��Һ�еμ�1 mL 0.5mol��L-1CaCl2��Һ | �ް�ɫ���� | NaHCO3��Һ�е�CO32��Ũ�Ⱥ�С,������CaCl2��Ӧ |
ʵ��ʵ���,���ֲ���2��������Ԥ���в���:������ɫ���������塣���������,NaHCO3��Һ��CaCl2��Һ��Ӧ�����ӷ���ʽΪ_______________________________��
���𰸡� 2NaHCO3![]() Na2CO3+CO2��+H2O ͬ�¶���,Na2CO3��NaHCO3������ˮ b��d �� a��c Ca2++CO32��=CaCO3�� Ca2++2HCO32��=CaCO3��+CO2��+H2O
Na2CO3+CO2��+H2O ͬ�¶���,Na2CO3��NaHCO3������ˮ b��d �� a��c Ca2++CO32��=CaCO3�� Ca2++2HCO32��=CaCO3��+CO2��+H2O
��������
���⣨1�� Na2CO3�ȶ������Ȳ��ֽ⣬��NaHCO3���ȶ������ȷֽ⡣��Ӧ�ķ���ʽΪ2NaHCO3 ![]() Na2CO3+ CO2��+ H2O����2������ͬ���¶��£�����ͬ������ˮ�ڼ������������Na2CO3��NaHCO3���������Na2CO3������ȫ�ܽ⣬��NaHCO3������ʣ��˵������ͬ���¶���Na2CO3��NaHCO3�������ܽ���ˮ�С���ʢ��Na2CO3���ձ��г��ֵ������Ǽ�ˮ�ܽ�ų�����ʹ��Һ���¶����ߣ��μӷ�̪��Һ����Һ��Ϊ��ɫ��˵����Һ�Լ��ԡ�������ȷѡ��ΪB D����3�������Թ��о������������в���������죬�������ķ�Ӧ�̶ȸ�Ϊ���ҡ������ķ�ӦΪ��NaHCO3+HCl=NaCl+H2O+ CO2��n(NaHCO3) ��n(HCl)=1:1�� n(NaHCO3)=1/84mol=0.012mol<n(HCl)=0.003mol,���Էų�����������������������㡣Na2CO3+ 2HCl=2NaCl+H2O+ CO2��n(Na2CO3) ��n(HCl)=1:2��n(Na2CO3)=" 1/106mol=" 0.009mol>2n(HCl)�����Էų������������������������㡣��Ϊ̼���������ᷴӦ�ֲ����У���һ������̼�����ƺ��Ȼ��ƣ�û�����壬�ڶ����ŷų����壬������Na2CO3��NaHCO3�ֱ���������������ȣ����Էų���������NaHCO3�ࡣ�����ȷѡ��ΪA C����4��Na2CO3��Һ��CaCl2��Һ��Ӧ�����ӷ���ʽΪ��Ca2++ CO32-="=" CaCO3����2 mL NaHCO3��Һ�еμ�1 mL 0.5 mol��L-1CaCl2��Һ��������ɫ���������塣�������£�NaHCO3��Һ��CaCl2��Һ��Ӧ�����ӷ���ʽΪCa2++ 2HCO3-="==" CaCO3��+ CO2��+ H2O��
Na2CO3+ CO2��+ H2O����2������ͬ���¶��£�����ͬ������ˮ�ڼ������������Na2CO3��NaHCO3���������Na2CO3������ȫ�ܽ⣬��NaHCO3������ʣ��˵������ͬ���¶���Na2CO3��NaHCO3�������ܽ���ˮ�С���ʢ��Na2CO3���ձ��г��ֵ������Ǽ�ˮ�ܽ�ų�����ʹ��Һ���¶����ߣ��μӷ�̪��Һ����Һ��Ϊ��ɫ��˵����Һ�Լ��ԡ�������ȷѡ��ΪB D����3�������Թ��о������������в���������죬�������ķ�Ӧ�̶ȸ�Ϊ���ҡ������ķ�ӦΪ��NaHCO3+HCl=NaCl+H2O+ CO2��n(NaHCO3) ��n(HCl)=1:1�� n(NaHCO3)=1/84mol=0.012mol<n(HCl)=0.003mol,���Էų�����������������������㡣Na2CO3+ 2HCl=2NaCl+H2O+ CO2��n(Na2CO3) ��n(HCl)=1:2��n(Na2CO3)=" 1/106mol=" 0.009mol>2n(HCl)�����Էų������������������������㡣��Ϊ̼���������ᷴӦ�ֲ����У���һ������̼�����ƺ��Ȼ��ƣ�û�����壬�ڶ����ŷų����壬������Na2CO3��NaHCO3�ֱ���������������ȣ����Էų���������NaHCO3�ࡣ�����ȷѡ��ΪA C����4��Na2CO3��Һ��CaCl2��Һ��Ӧ�����ӷ���ʽΪ��Ca2++ CO32-="=" CaCO3����2 mL NaHCO3��Һ�еμ�1 mL 0.5 mol��L-1CaCl2��Һ��������ɫ���������塣�������£�NaHCO3��Һ��CaCl2��Һ��Ӧ�����ӷ���ʽΪCa2++ 2HCO3-="==" CaCO3��+ CO2��+ H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��һ�ָ��۵㻯������������ᡢ���ᣬȴ��������C��һ�����壻D�ǰ�ɫ��״������A��B��C��D֮���ת����ͼ�����ƶ�:

A.______��B.______��C.______�� D.______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йر仯���̣�������������ԭ��Ӧ���ǣ� ��
A.�ղ��ù��������������ó����ֺ���ɫ��
B.��ú����ȼ����Ȼ��Ϊ�����ṩ����
C.ţ�̾��ÿ����б��ʸ���
D.���ˮ�е���FeCl3������Һ���ʵ����ȣ��Ʊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ�����и����е����ӣ�������Һ�д���������ǣ� ��
A.Cu2+��H+��Cl����SO42��
B.Na+��Fe3+��SO42����OH��
C.H+��Na+��CO32����NO32��
D.K+��Na+��Cl����OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��Ϊ������Ԫ�أ�XԪ�ص���̬�⻯���ˮ��Һ������ɫ��̪��죬YԪ�ص������������Ǵ�����������2����ZԪ���Ƕ�����Ԫ����ԭ�Ӱ뾶����Ԫ�أ�He��Ne��Ar���⣩��
��1��д��X��Ԫ�ط��� ����ԭ�ӽṹʾ��ͼΪ ��
��2��Ԫ��Y������⻯��Ļ�ѧʽ ��
��3��ZԪ��ԭ�ӵ�������Ϊ ��ZԪ�ص�����������Ӧ��ˮ����ĵ���
ʽΪ ��
��4��XԪ������������Ӧ��ˮ��������������Ӧ�����ӷ���ʽΪ ��
��5��YԪ�ص�����������ZԪ�صĹ��������������ԭ��Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ������ʴ�ı����ǽ���ԭ�ӱ���ԭ
B. ����ʱͭ����������ֱ��š��һ��
C. �Ʋ������п���ȶ�������������
D. ����ˮ�����þ����Ϊ�����ڵ��ͼ��ȹ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭ��Ӧʵ�ʵ���������ȷ����( )
A.����Ԫ�ز��뷴ӦB.����Ԫ�ز��뷴Ӧ
C.��Ԫ�ط������ϼ۱仯D.�е��ӵĵ�ʧ�����ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������������ǵ�����������ʡ�
(1)�γ������ԭ��֮һ�ɼ�ʾ���£�
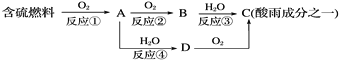
�ش��������⣺
�������pH________(���������������=��)5.6��
��D���ʵĻ�ѧʽΪ____________��
�۷�Ӧ�ڵĻ�ѧ����ʽΪ_________________________________________��
(2)��һ�������°��������������������ת��Ϊ����Ⱦ�����ʡ�д�������Ͷ���������һ�������·�Ӧ�Ļ�ѧ����ʽ��__________________����Ӧ����������____________����ԭ����_______________��
(3)������������Һ�������շ����еĵ��������Ӧ�Ļ�ѧ����ʽ���£�
NO2+NO+2NaOH===2NaNO2+H2O��2NO2+2NaOH===NaNO2+NaNO3+H2O
����VLijNaOH��Һ����ȫ����n molNO2��m molNO��ɵĴ�����Ⱦ�
�������ռ���Һ�����ʵ���Ũ������Ϊ________ mol��L1��
����������Һ��c(NO3��)��c(NO2��)=1��9����ԭ���������NO2��NO�����ʵ���֮��n��m=______��
���ú�n��m�Ĵ���ʽ��ʾ������Һ��NO3����NO2��Ũ�ȵı�ֵc(NO3��)��c(NO2��)=________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����KCl��MgCl2��Mg��NO3��2�γɵĻ����Һ�У�c��K+��=0.1mol/L��c��Mg2+��=0.15mol/L��c��Cl����=0.2mol/L����c��NO3����Ϊ�� ��
A.0.05 mol/L
B.0.20 mol/L
C.0.30 mol/L
D.0.40 mol/L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com