
����Ŀ��Ϊ��̽��Cl2��SO2ͬʱͨ��H2O�з����ķ�Ӧ��ijУ��ѧ��ȤС��ͬѧ�������ͼ��ʾ��ʵ��װ�á�

��1���û�ѧ��ȤС���ͬѧΪ��ȡCl2��SO2���壬�ֲ���Na2SO3��70%������Ϊԭ����ȡSO2������MnO2��Ũ����(12 mol��L��1)Ϊԭ����ȡCl2���ڴ�ʵ���У�F������������________������װ��BӦѡ����������װ���е�________(�����)��

��2��Dװ������Ҫ��Ӧ�����ӷ���ʽΪ____________________________________________________��
��3��Ϊ��֤ͨ��Dװ���е�������Cl2��������SO2��������ȤС���ͬѧ���������Լ���
���Ȼ�����Һ�����Ȼ�������Һ�������軯����Һ�������Ը��������Һ
��Cl2������ȡ����D����Һ�μ���ʢ��________(��һ����ţ���ͬ)�Լ����Թ��ڣ��ټ���________�Լ���������������_____________________________________________��
��SO2������ȡ����D����Һ�μ���ʢ��________�Լ����Թ��ڣ�������������________________________________________________________________________��
���𰸡� ������ �� Cl2��SO2��2H2O��4H����SO42����2Cl�� �� �� ��Һ�ʺ�ɫ �� �Ϻ�ɫ��Ϊ��ɫ
����������1��SO2����ˮ��Ӧ�����ܽ�Ƚϴ�ᷢ����������Fװ�õ������ǿ��Է�������װ��BΪ��ȡ������װ�ã��ɹ�Һ��Ӧ�Ҽ��ȵ�ԭ����֪Ӧѡ��٣���2��D���Ƕ������������������������ԭ��Ӧ������������ᣬ��Ӧ�����ӷ���ʽΪCl2��SO2��2H2O��4H����SO42����2Cl������3����Cl2��������ˮ����ǿ�����ԣ������ȡ����D����Һ�μ���ʢ���Ȼ�������Һ�Լ����Թ��ڣ��ټ������軯����Һ���Ѫ��ɫ��֤�����������������ӣ���SO2����������������л�ԭ�ԣ������ȡ����D����Һ�μ���ʢ�����Ը��������Һ���Թ��У�������������������Ϻ�ɫ��Ϊ��ɫ֤�����ж�������


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.������ָ������ڵ��������½�������ӵĹ���
B.����ˮ���ܵ����H+�Ļ����ﶼ����
C.�Ȼ�������ˮ�ܵ��磬����Ȼ����ǵ����
D.�Ȼ��ƹ��岻���磬�����Ȼ��Ʋ��ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ������ʴ�ı����ǽ���ԭ�ӱ���ԭ
B. ����ʱͭ����������ֱ��š��һ��
C. �Ʋ������п���ȶ�������������
D. ����ˮ�����þ����Ϊ�����ڵ��ͼ��ȹ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����в��ᷢ����ѧ�仯����
A. ��ɫ��Ӧ B. ú��Һ�� C. �������Ƴ��ڷ��� D. ������������Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������������ǵ�����������ʡ�
(1)�γ������ԭ��֮һ�ɼ�ʾ���£�
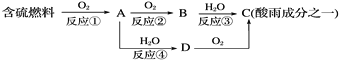
�ش��������⣺
�������pH________(���������������=��)5.6��
��D���ʵĻ�ѧʽΪ____________��
�۷�Ӧ�ڵĻ�ѧ����ʽΪ_________________________________________��
(2)��һ�������°��������������������ת��Ϊ����Ⱦ�����ʡ�д�������Ͷ���������һ�������·�Ӧ�Ļ�ѧ����ʽ��__________________����Ӧ����������____________����ԭ����_______________��
(3)������������Һ�������շ����еĵ��������Ӧ�Ļ�ѧ����ʽ���£�
NO2+NO+2NaOH===2NaNO2+H2O��2NO2+2NaOH===NaNO2+NaNO3+H2O
����VLijNaOH��Һ����ȫ����n molNO2��m molNO��ɵĴ�����Ⱦ�
�������ռ���Һ�����ʵ���Ũ������Ϊ________ mol��L1��
����������Һ��c(NO3��)��c(NO2��)=1��9����ԭ���������NO2��NO�����ʵ���֮��n��m=______��
���ú�n��m�Ĵ���ʽ��ʾ������Һ��NO3����NO2��Ũ�ȵı�ֵc(NO3��)��c(NO2��)=________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼú���ŷŴ�����CO��CO2��SO2��PM2.5(����ο�����)����Ⱦ������ȼú������أ�SO2. CO��CO2Ҳ�ǶԻ���Ӱ��ϴ�����壬�����ǵĺ������ơ��������Ż��������滷������Ч;����
��1����ҵ�Ͽ���CO2��H2��Ӧ�ϳɼ״�����֪25��C��101 kPa�£�
H2(g)+1/2O2(g)=H2O (g) ��H1=��242kJ/mol
CH3OH+3/2O2(g) =CO2(g)+2H2O ��H2=��676kJ/mol
д��CO2��H2��Ӧ����CH3OH(g)��H2O (g)���Ȼ�ѧ����ʽ_________________��
��2����ҵ�ϻ�����ͨ�����з�Ӧ�Ʊ��״���CO (g) +2H2 (g)![]() CH3OH (g)����һ�ݻ��ɱ���ܱ������г���l0molCO��20molH2��CO��ƽ��ת�������¶�(T)��ѹǿ(P)�ı仯��ͼ��ʾ��
CH3OH (g)����һ�ݻ��ɱ���ܱ������г���l0molCO��20molH2��CO��ƽ��ת�������¶�(T)��ѹǿ(P)�ı仯��ͼ��ʾ��

������˵�������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����____������ĸ����
a. H2���������ʵ���CH3OH���������ʵ�2��
b��H2������������ٸı�
c����ϵ��H2��ת���ʺ�CO��ת�������
d����ϵ�������ƽ��Ħ���������ٸı�
�ڱȽ�A��B����ѹǿ��СPA____PB���>����<����=��������
�����ﵽ��ѧƽ��״̬Aʱ�����������Ϊ20 L�������Ӧ��ʼʱ�Գ���10 mol CO��20molH2������ƽ��״̬Bʱ���������V(B��=________L��
��3��SO2��һ�������¿�����������ԭ��ء���ͼ�����øõ�����������ͭ��װ��ʾ��ͼ��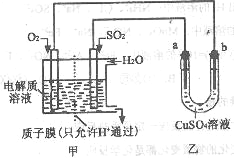
�� �õ�صĸ�����Ӧ��___________________��
�ڵ���������2.24LO2����״����ʱ������a������____g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������и��⣮
(1)�����£�Ũ�Ⱦ�Ϊ 0.1molL��1 ����������������Һ�� pH �����
���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
��������Һ�е������ӣ����H+������ǿ���� �����ݱ������ݣ�Ũ�Ⱦ�Ϊ0.01molL��1 ���������������Һ�ֱ�ϡ�� 100����pH�仯������ (����)��
A��HCN B��HClO C��CH3COOH D��H2CO3
(2)����100ml 0.1mol/L NaHCO3��100ml 0.1mol/L Na2CO3 ������Һ��
��Һ��ˮ�������OH-�������� ��(���������=����������ͬ)��
��Һ�������ӵ����ʵ���Ũ��֮�ͣ��� ����
(3)NaCN��ˮ�ɲ�����ȼ��HCN���壬Ũ�Ⱦ�Ϊ0.1mol��L��NaCN��HCN�Ļ��Һ�еμӷ�̪����Һ��죬����Һ�и����ӵ�Ũ�ȴ�С��ϵΪ_______________________��
(4)�о�֤ʵ��CO2��������ˮ��Һ��ͨ��������ɼ״�(CH3OH)�������ɼ״��ķ�Ӧ������ (������������)���õ缫��Ӧʽ�� ��
(5)��֪Ksp(CuS)��1.3��10��36��Ksp(NiS)��1.0��10��24���ں�Cu2����Ni2������Һ�У���Ni2��ǡ����ȫ����[��ʱ��Һ��c(Ni2��)��1.0��10��5 mol��L��1]����Һ��Cu2����Ũ����_____________mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����HClO4-NaClO4������,K5[Co3+O4W12O36](���ΪCo3+W)������NH2OH�Ĺ�������:

��1��Co2+��̬��������Ų�ʽΪ________��
��2��NH2OH�����е�ԭ�ӹ�����ӻ�������_______��lmolNH2OH�����к�����������ĿΪ_______��
��3��N��H��O����Ԫ�صĵ縺����С�����˳��Ϊ_________��
��4��ClO4-�Ŀռ乹��Ϊ__________��
��5��һ������̼�γɵļ�϶������ľ���ṹ����ͼ��ʾ������̼ԭ��λ����ԭ���γɵİ���������ģ�ÿ����ԭ����Ϊ���������干�ã���û�����Ļ�ѧʽΪ_________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��������CH2=CHCOOCH2CH3����Է�������Ϊ100���ɹ㷺��������Ϳ�ϡ��ϼ���ijʵ��С��������ͼ��ʾ��װ�úϳɱ�ϩ�����������ּгּ�����װ����ʡ�ԣ�������Ϊ�Ƚ�34.29 mL��ϩ�ᣨCH2=CHCOOH���ܶ�Ϊ1.05 g��mL-l����������B�У��߽����ͨ������A���������Ҵ���Ũ����Ļ��Һ����������ַ�Ӧ���Իش��������⣺

(1)����D��������____��
(2)����C����ˮӦ��____������c������b�����ڽ��롣
(3)���������Լ��ͷ����ᴿ��ϩ������������������ˮϴ�Ӻ��Һ����������������Na2C03��Һ���Һ��������ˮNa2SO4�������������˳��Ϊ_____������ţ���
(4)д�����ɱ�ϩ�������Ļ�ѧ����ʽ______�����õ�35.0 g����ı�ϩ�����������ϩ�������IJ���Ϊ_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com