
【题目】燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)。污染跟冬季燃煤密切相关,SO2. CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)工业上可用CO2和H2反应合成甲醇。已知25°C、101 kPa下:
H2(g)+1/2O2(g)=H2O (g) △H1=—242kJ/mol
CH3OH+3/2O2(g) =CO2(g)+2H2O △H2=—676kJ/mol
写出CO2与H2反应生成CH3OH(g)与H2O (g)的热化学方程式_________________。
(2)工业上还可以通过下列反应制备甲醇:CO (g) +2H2 (g)![]() CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。

①下列说法不能判断该反应达到化学平衡状态的是____(填字母)。
a. H2的消耗速率等于CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA____PB(填“>”“<”或“=’’)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 mol CO和20molH2,则在平衡状态B时容器的体积V(B)=________L。
(3)SO2在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀铜的装置示意图: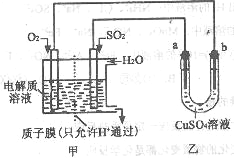
① 该电池的负极反应:___________________;
②当甲中消耗2.24LO2(标准状况)时,乙中a极增重____g。
【答案】 CO2(g)+3H2(g) =CH3OH(g)+H2O(g) ΔH=-50 kJ/mol ac < 4 SO2-2e-+2H2O=4H++SO42- 12.8
【解析】(1)①H2(g)+1/2O2(g)=H2O (g) △H1=—242kJ/mol ,②CH3OH+3/2O2(g) =CO2(g)+2H2O △H2=—676kJ/mol,将方程式3①-②得CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=3×(-242kJ/mol)-(-676kJ/mol)=-50kJ/mol;CO2与H2反应生成CH3OH(g)与H2O (g)的热化学方程式:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50kJ/mol
(2)①a. H2的消耗速率等于CH3OH的生成速率的2倍,说明正逆反应速率相等,但方向相同,则不能说明达到化学平衡状态,a选;
b.H2的体积分数不再改变,说明H2 的浓度不再改变,说明达到化学平衡状态,b不选;
c.体系中H2的转化率和CO的转化率相等,不能说明达到化学平衡状态,c选;
d.由于该反应是个反应前后气体体积不等的反应,如果反应未达到平衡,则气体的物质的量就会发生改变,混合气体的平均相对分子质量也就会随着改变。若容器中混合气体的平均相对分子质量保持不变,则气体的物质的量不变。故反应达到平衡状态。d不选。所以选ac。
②T1时,由A到B,CO的平衡转化率增大,平衡正向移动,向体积减小的方向移动,故A、B两点压强大小PA<PB。
③若密闭容器中充入10 mol CO 和20 molH2,当达到平衡状态A 时,CO的转化率为0.5,此时各物质的物质的量为CO为5mol;H2为10mol; CH3OH为5mol。n(气体)=20mol,容器的体积为20 L。如反应开始时仍充入10mol CO 和20mol H2,在达到平衡状态B时CO的转化率为0.8,则此时各物质的物质的量为CO为2mol,H2为4mol, CH3OH为8mol。n(气体)=14mol。由于A、B是在相同温度下程度的。所以化学平衡常数不变设第二次达到平衡时容器的体积为V。则 ,解得v=4(L)
,解得v=4(L)
(3)①甲池为原电池,是燃料电池,SO2作为负极材料,失去电子,电极反应式为:SO2-2e-+2H2O=4H++SO42- ,正极为O2,燃料电池中正极反应为O2+2H++4e-=2H2O,②乙池是电解池,a极接燃料电池的负极,故a极为电解池阴极,Cu2+放电,电极反应式:Cu2+ +2 e- = Cu,根据O2+2H++4e-=2H2O,Cu2+ +2 e- = Cu,可得O2-4e--2Cu,得甲中消耗2.24LO2(标准状况),即0.1mol时,转移电子数为4mol,乙中a极析出Cu为增重12.8g。


科目:高中化学 来源: 题型:
【题目】已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)常温下,在pH =5的稀醋酸溶液中,c(CH3COO-)=_______________________(不必化简)。下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是_________________
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)________________V(醋酸),反应的最初速率为:υ(盐酸)___________υ(醋酸)。(填写“>”、“<”或“=”)
(3)常温下,向体积为Va mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系为:_________________。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为__________________________________。
(5)已知:90℃时,水的离子积常数为Kw=3.8×10-13,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=______________(保留三位有效数字)mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下表:
实验分组 | 所用金属 | 电子流向 |
① | A、Cu | A→Cu |
② | C、D | D→C |
③ | A、C | C→A |
④ | B、Cu | Cu→B |
⑤ | …… | …… |

根据上述情况,回答下列问题:
(1)五种金属的活动性按从大到小的顺序是____________________。
(2)在①中,Cu片上观察到的现象是____________________。
(3)在②中,溶液中H+向金属片________移动。
(4)如果实验⑤用B、D作电极,则导线中电流方向为________(填“B→D”或“D→B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。

(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是________;发生装置B应选择以下三种装置中的________(填序号)。

(2)D装置中主要反应的离子方程式为____________________________________________________。
(3)为验证通入D装置中的气体是Cl2过量还是SO2过量,兴趣小组的同学准备了以下试剂:
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④酸性高锰酸钾溶液
若Cl2过量,取适量D中溶液滴加至盛有________(填一个序号,下同)试剂的试管内,再加入________试剂。发生的现象是_____________________________________________。
若SO2过量,取适量D中溶液滴加至盛有________试剂的试管内,发生的现象是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:![]()
B. 若x<3,C的平衡浓度关系为:c(M)<c(N)
C. 若x>3,达到平衡后B的转化率关系为:![]()
D. x不论为何值,平衡时M、N中的平均相对分子质量都相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定物质的所占有体积约为最大的是( )
A.标准状况下56 g 铁原子
B.标准状况下1mol C2H5OH
C.标准状况下6.02×1023 个NH3
D.通常状况下1molHCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质一定属于同系物的是( )
①![]() ②
②![]() ③
③![]() ④C2H4⑤CH2==CH—CH==CH2 ⑥C3H6 ⑦
④C2H4⑤CH2==CH—CH==CH2 ⑥C3H6 ⑦![]() ⑧
⑧![]()
A. ⑦⑧ B. ⑤⑦ C. ①②③ D. ④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH- 离子浓度分别为Amol/L与Bmol/L,则A和B关系为( )
A. A>B B. A=10-4 B C. B=10-4 A D. A=B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com