
【题目】现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下表:
实验分组 | 所用金属 | 电子流向 |
① | A、Cu | A→Cu |
② | C、D | D→C |
③ | A、C | C→A |
④ | B、Cu | Cu→B |
⑤ | …… | …… |

根据上述情况,回答下列问题:
(1)五种金属的活动性按从大到小的顺序是____________________。
(2)在①中,Cu片上观察到的现象是____________________。
(3)在②中,溶液中H+向金属片________移动。
(4)如果实验⑤用B、D作电极,则导线中电流方向为________(填“B→D”或“D→B”)。
【答案】 D>C>A>Cu>B 有无色气泡生成 C B→D
【解析】(1)现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中,构成原电池,电子由负极流向正极,即负极失电子,金属活泼性大于正极材料,A→Cu(A>Cu),类推可得,五种金属的活动性由大到小的顺序是D>C>A>Cu>B;
(2)在①中,电解质为稀硫酸,A失去电子,溶液中氢离子在Cu片上得电子产生氢气,所以在铜片可以看到有无色气泡生成;
(3)同理,在②中,溶液中H+到C金属片上得电子,故氢离子向C金属片移动。
(4)若用B、D作电极,稀硫酸作电解质,因D的金属活泼性大于B,故D作负极,失去电子,电子由D流向B。


科目:高中化学 来源: 题型:
【题目】下列关于说法正确的是
A. HCl和NaOH反应的中和热为57.3kJ/mol,H2SO3和NaOH反应的中和热也为57.3kJ/mol
B. 已知C2H5OH(l)的燃烧热是1366.8kJ/mol,则C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)反应的△H=﹣1366.8kJ/mol
C. 在一定温度和压强下,将0.5mol N2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=﹣38.6kJ/mol
2NH3(g) △H=﹣38.6kJ/mol
D. 一定条件下2SO2(g)+O2(g)2SO3(g) △H1 ,2SO2(g)+O2(g)2SO3(l) △H2 则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期。甲、乙、己是由这些元素组成的二元化合物。 0.001 molL-1 的己溶液pH为3;庚是具有漂白性的混合物。上述物质的转化关系如图所示。下列说法正确的是:( )

A. 原子半径Z>Y>X
B. 仅由这四种元素构成的溶液可能呈酸性、碱性或中性
C. 己为由极性键构成的非极性分子
D. 戊为一元弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两圆圈相交的部分表示圆圈内的物质相互反应,已知钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g。下列说法正确的是

A.反应③最多能产生0.05 mol O2
B.反应①的离子方程式为Na+2H2O==Na++2OH-+H2↑
C.Na2O2中阴阳离子数目之比为1∶1
D.①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 金属腐蚀的本质是金属原子被还原
B. 接线时铜线与铝线能直接拧在一起
C. 镀层破损后,镀锌铁比镀锡铁更易生锈
D. 电热水器里放镁棒是为保护内胆和加热管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) | ΔH3 | K3 | |||
请回答下列问题:
(1)反应②是________(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示);根据反应③判断ΔS___0(填“>”、“=”或“<”),在______(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol/L、0.8mol/L、0.3mol/L、0.15mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)。污染跟冬季燃煤密切相关,SO2. CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)工业上可用CO2和H2反应合成甲醇。已知25°C、101 kPa下:
H2(g)+1/2O2(g)=H2O (g) △H1=—242kJ/mol
CH3OH+3/2O2(g) =CO2(g)+2H2O △H2=—676kJ/mol
写出CO2与H2反应生成CH3OH(g)与H2O (g)的热化学方程式_________________。
(2)工业上还可以通过下列反应制备甲醇:CO (g) +2H2 (g)![]() CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。

①下列说法不能判断该反应达到化学平衡状态的是____(填字母)。
a. H2的消耗速率等于CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA____PB(填“>”“<”或“=’’)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 mol CO和20molH2,则在平衡状态B时容器的体积V(B)=________L。
(3)SO2在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀铜的装置示意图: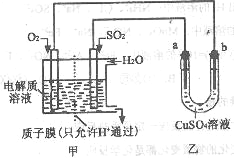
① 该电池的负极反应:___________________;
②当甲中消耗2.24LO2(标准状况)时,乙中a极增重____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物a和苯通过反应合成b的过程可表示为下图(无机小分子产物略去)。下列说法正确的是

A. 该反应是加成反应
B. 若R为CH3时,b中所有原子可能共面
C. 若R为C4H9时,取代b苯环上的氢的一氯代物的可能的结构共有12种
D. 若R为C4H5O时,lmol b最多可以与6mol H2加成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com