
【题目】已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)常温下,在pH =5的稀醋酸溶液中,c(CH3COO-)=_______________________(不必化简)。下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是_________________
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)________________V(醋酸),反应的最初速率为:υ(盐酸)___________υ(醋酸)。(填写“>”、“<”或“=”)
(3)常温下,向体积为Va mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系为:_________________。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为__________________________________。
(5)已知:90℃时,水的离子积常数为Kw=3.8×10-13,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=______________(保留三位有效数字)mol/L。
【答案】 (10-5-10-9)mol/L bcf < = Va< Vb c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-) 2.05×10-11
【解析】(1)在pH=5的稀醋酸溶液中,c(H+)=10-5mol/L,根据水的电离平衡及醋酸的电离平衡方程式CH3COOH![]() H++CH3COO-可以看出,c(CH3COO-)=c(H+)溶液-c(H+)水=(10-5-10-9) mol/L;加热、加水稀释、加入碱性物质均能使电离平衡向右移动,故选bcf。
H++CH3COO-可以看出,c(CH3COO-)=c(H+)溶液-c(H+)水=(10-5-10-9) mol/L;加热、加水稀释、加入碱性物质均能使电离平衡向右移动,故选bcf。
(2)醋酸是弱酸,等体积等pH,则n(CH3COOH)>n(HCl),则盐酸中锌粉剩余,随着它和金属的反应,电离平衡不断地向右移动,会电离出更多的氢离子,所以醋酸产生的氢气体积较大,开始时,醋酸和盐酸的pH均等于3,即开始时氢离子的浓度相等,所以开始时的速率相等。
(3)醋酸是弱酸,pH为3的醋酸溶液中,CH3COOH的浓度大于10-3mol/L,pH=11的NaOH溶液浓度等于10-3mol/L,最后溶液恰好呈中性,说明碱过量,所以Va<Vb。
(4)根据电荷守恒:c(CH3COO-)+c(Cl-)+c(OH-)=c(Na+)+c(H+),溶液为中性,可以知道c(CH3COO-)+c(Cl-)=c(Na+),所以c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-)。
(5)pH=3的盐酸中c(H+)=10-3mol/L,pH=11的氢氧化钠溶液中:c(OH-)=![]() =38×10-3mol/L,混合后碱剩余,剩余的氢氧根的浓度为:c(OH-)=
=38×10-3mol/L,混合后碱剩余,剩余的氢氧根的浓度为:c(OH-)=![]() ="0.018" 5 mol/L,
="0.018" 5 mol/L,
所以c(H+)=![]() mol/L≈2.05×10-11mol/L。
mol/L≈2.05×10-11mol/L。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】药物比卡鲁安(G)可以通过以下方法合成:

(1)B 中的含氧官能团名称为__________________;
(2)B→C 的反应类型为___________________;
(3)写出同时满足下列条件的 D 的一种同分异构体的结构简式:__________________;
①有苯环;②能使溴的 CCl4 溶液褪色;③分子中有 2 种不同化学环境的氢
(4)合成 F 时还可能生成一种副产物 X,X 的结构简式为___________________;
(5)已知 : 苯胺 (![]() ) 易被氧化,请以甲苯和甲醇为原料制备
) 易被氧化,请以甲苯和甲醇为原料制备 。_____________________
。_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于说法正确的是
A. HCl和NaOH反应的中和热为57.3kJ/mol,H2SO3和NaOH反应的中和热也为57.3kJ/mol
B. 已知C2H5OH(l)的燃烧热是1366.8kJ/mol,则C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)反应的△H=﹣1366.8kJ/mol
C. 在一定温度和压强下,将0.5mol N2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=﹣38.6kJ/mol
2NH3(g) △H=﹣38.6kJ/mol
D. 一定条件下2SO2(g)+O2(g)2SO3(g) △H1 ,2SO2(g)+O2(g)2SO3(l) △H2 则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如下图所示,且每一段只对应一个反应。下列说法正确的

A. 开始时产生的气体为H2
B. AB段产生的反应为置换反应
C. 所用混合溶液中c(HNO3)=0.5mol·L-1
D. 参加反应铁粉的总质量m2=5.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.电离是指电解质在电流作用下解离出离子的过程
B.溶于水后能电离出H+的化合物都是酸
C.氯化氢溶于水能导电,因此氯化氢是电解质
D.氯化钠固体不导电,所以氯化钠不是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质属于电解质的一组是( )
A.CO2、NH3、HCl
B.H2SO4、HNO3、BaCl2
C.H3PO4、H2O、Cu
D.液态KNO3、NaOH溶液、CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期。甲、乙、己是由这些元素组成的二元化合物。 0.001 molL-1 的己溶液pH为3;庚是具有漂白性的混合物。上述物质的转化关系如图所示。下列说法正确的是:( )

A. 原子半径Z>Y>X
B. 仅由这四种元素构成的溶液可能呈酸性、碱性或中性
C. 己为由极性键构成的非极性分子
D. 戊为一元弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两圆圈相交的部分表示圆圈内的物质相互反应,已知钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g。下列说法正确的是

A.反应③最多能产生0.05 mol O2
B.反应①的离子方程式为Na+2H2O==Na++2OH-+H2↑
C.Na2O2中阴阳离子数目之比为1∶1
D.①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)。污染跟冬季燃煤密切相关,SO2. CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)工业上可用CO2和H2反应合成甲醇。已知25°C、101 kPa下:
H2(g)+1/2O2(g)=H2O (g) △H1=—242kJ/mol
CH3OH+3/2O2(g) =CO2(g)+2H2O △H2=—676kJ/mol
写出CO2与H2反应生成CH3OH(g)与H2O (g)的热化学方程式_________________。
(2)工业上还可以通过下列反应制备甲醇:CO (g) +2H2 (g)![]() CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。

①下列说法不能判断该反应达到化学平衡状态的是____(填字母)。
a. H2的消耗速率等于CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA____PB(填“>”“<”或“=’’)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 mol CO和20molH2,则在平衡状态B时容器的体积V(B)=________L。
(3)SO2在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀铜的装置示意图: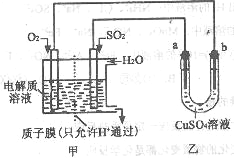
① 该电池的负极反应:___________________;
②当甲中消耗2.24LO2(标准状况)时,乙中a极增重____g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com