
【题目】用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按如图所示步骤分开五种离子。则溶液①②③④是( )
A.①NaCl ②NaOH ③NH3·H2O ④H2SO4
B.①H2SO4 ②NaOH ③NH3·H2O ④NaCl
C.①H2SO4 ②NH3·H2O ③NaOH ④NaCl
D.①NaCl ②NH3·H2O ③NaOH ④H2SO4
【答案】D
【解析】根据溶液中含有Fe3+、Al3+、Ba2+、Ag+、K+ , 而用的分离试剂为H2SO4、NaOH、NH3·H2O、NaCl溶液,结合题目的分离流程图示,第①步只分离出一种沉淀,所以只能向溶液中加入NaCl溶液使Ag+沉淀而分出,同时对其他离子无影响,因此试剂①为NaCl溶液;这样余下的溶液中只有Fe3+、Al3+、Ba2+、K+ , 而加入试剂②后得到的沉淀和溶液均需要再加入试剂进行分离,说明加入试剂②后将得到两种离子的沉淀,另两种离子则在溶液中,因此试剂②为NH3·H2O,形成的沉淀为Fe(OH)3和Al(OH)3 , 另两种离子Ba2+和K+则留在溶液中;对于沉淀Fe(OH)3和Al(OH)3只能用NaOH溶液将二者分离,而对溶液中的Ba2+和K+则可以通过加入硫酸溶液使Ba2+形成BaSO4沉淀而分离,所以试剂③为NaOH溶液,试剂④为H2SO4溶液。


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】1,6-己二酸(G)是合成尼龙的重要原料之一,可用六个碳原子的化合物氧化制备.如图为A通过氧化反应制备G的反应过程(可能的反应中间物质为B、C、D、E和F).回答问题: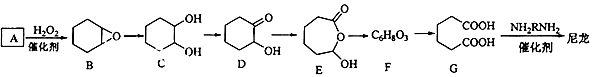
(1)化合物A中含碳87.8%,其余为氢,A的化学名称为;
(2)B到C的反应类型为;
(3)F的结构简式为;
(4)在上述中间物质中,核磁共振氢谱中峰最多的是 , 最少的是(填化合物代号,可能有多选)。
(5)由G合成尼龙的化学方程式为;
(6)由A通过两步制备1,3﹣环己二烯的合成线路为(样式:A条件和试剂B一定条件 C)。
(7)有机物C的同分异构体属于酯类的有种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应及相关概念的叙述正确的是
A.碱性氧化物一定是金属氧化物
B.溶于水能导电的化合物一定是电解质
C.冰与水之间的相互转化是化学变化
D.有单质生成的反应一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在加入铝粉能放出氢气的溶液中,下列各组离子可能共存的是( )
A.NH ![]() 、NO
、NO ![]() 、CO
、CO ![]() 、Na +
、Na +
B.Na+、Ba2+、Mg2+、HCO ![]()
C.NO ![]() 、K+、[Al(OH)4]﹣、OH﹣
、K+、[Al(OH)4]﹣、OH﹣
D.NO ![]() 、Mg2+、K+、Cl﹣
、Mg2+、K+、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应,但H2O既不做氧化剂,也不做还原剂的是( )
A. Cl2+H2O=HCl+HClO B. 2Na+2H2O=2NaOH+H2↑
C. 2F2+2H2O=4HF+O2 D. CaO+H2O=Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得悬浊液中逐滴加入1.00mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。 试回答:

(1)A点的沉淀物的化学式为__________________,B点的沉淀物的化学式为_____________________。
(2)写出A点到B点发生反应的离子方程式_________________________________________________。
(3)原混合物中MgCl2的质量是__________,AlCl3的质量是______________,NaOH的质量是____________。
(4)C点HCl溶液加入量为________________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.非金属元素(稀有气体元素除外)都是主族元素,单质在反应中都只能作氧化剂
B.常温下,1 mol氯气和足量稀NaOH溶液完全反应转移1mol电子
C.在加热条件下,用乙醇除去乙酸乙酯中的乙酸
D.硫酸铜溶液显酸性的原因:Cu2+ + 2H2O = Cu(OH)2↓+ 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废铁屑表面常有铁锈(成分为Fe2O3),并沾有油污。某校研究性学习小组设计实验方案,按以下①~④步骤用废铁屑制备绿矾(FeSO4·7H2O)晶体。
废铁屑 ![]() 铁屑
铁屑![]() 溶液(留有少量铁屑)
溶液(留有少量铁屑)![]() 滤液
滤液 ![]() 绿矾晶体
绿矾晶体
根据该实验方案,回答下列问题:
(1)步骤①中废铁屑与NaOH溶液共热的目的是。
(2)步骤②中烧杯底部留有少量铁屑的理由是。
说明剩余铁屑作用的离子方程式为。
(3)在步骤③中,该小组采用如图抽气过滤(减压过滤)装置代替普通漏斗,其目的是;。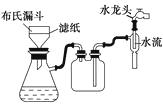
(4)检查步骤③的滤液中没有Fe3+的方法是。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com