
| A、Mg的摩尔质量为24g |
| B、物质的量的单位是摩尔 |
| C、1 mol O2在任何条件下的体积都为22.4L |
| D、将1 mol NaCl晶体加入到1L水中,得到NaCl溶液的浓度就是1 mol?L-1 |


科目:高中化学 来源: 题型:
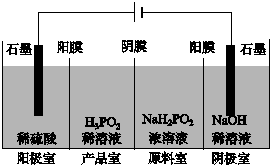 次磷酸(H3PO2)也是一种中强酸,具有强还原性,与足量NaOH反应生成NaH2PO2.H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
次磷酸(H3PO2)也是一种中强酸,具有强还原性,与足量NaOH反应生成NaH2PO2.H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):查看答案和解析>>
科目:高中化学 来源: 题型:
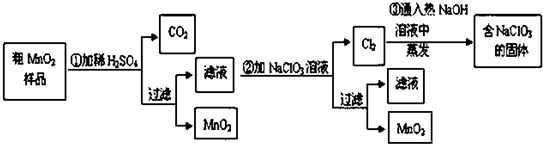
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤ | B、①④ | C、②③ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
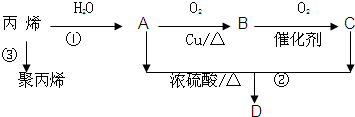
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
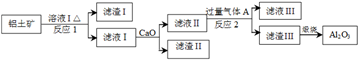
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 20 | 40 | 60 |
| n(PCl5) | 4 | 2.8 | 2 | 2 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com