
【题目】研究金属桥墩腐蚀及防护是跨海建桥的重要课题.下列有关判断中正确的是( ) 
A.用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀
B.②中桥墩与外加电源正极连接能确保桥墩不被腐蚀
C.③中采用了牺牲阳极的阴极保护法保护桥墩
D.①②③中海水均是实现化学能与电能相互转化的电解质
【答案】C
【解析】解:A、是吸氧腐蚀,a极是氧气得电子生成氢氧根离子,而铁是负极发生氧化反应生成亚铁离子,铁被腐蚀,故A错误; B、金属作电解池的阴极被保护,而铁与电源正极相连是阳极发生氧化反应,故B错误;
C、锌比铁活泼,所以锌失电子,所以③中采用了牺牲阳极的阴极保护法保护桥墩,故C正确;
D、海水是混合物,不是化合物,既不是电解质,也不是非电解质,故D错误;
故选C.
【考点精析】关于本题考查的金属的电化学腐蚀与防护,需要了解金属的保护:涂保护层;保持干燥;改变金属的内部结构,使其稳定;牺牲阳极的阴极保护法即用一种更为活泼的金属与要保护的金属构成原电池;外加电源法才能得出正确答案.


科目:高中化学 来源: 题型:
【题目】某元素的原子最外层只有一个电子,它与卤素结合时,所形成的化学键是( )
A.一定是离子键
B.一定是共价键
C.可能是离子键,也可能是共价键
D.以上说法都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组制备氢氧化亚铁沉淀.
实验1 |
| 实验现象 |
液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成. |
(1)实验1中产生白色沉淀的离子方程式是 .
(2)为了探究沉淀变灰绿色的原因,该小组同学展开如下探究: ①甲同学推测灰绿色物质为Fe(OH)2和Fe(OH)3混合物.查阅资料后根据调色原理认为白色和红褐色的调和色不可能是灰绿色,并设计实验证实灰绿色物质中不含有Fe(OH)3 , 方案是 .
②乙同学查阅文献:Fe(OH)2在大量SO42﹣存在的情况下形成Fe6(SO4)2(OH)4O3(一种氧基碱式复盐).并设计对比实验证实该假设:向试管中加入 , 再往试管中加入 , 振荡,现象与实验1相同,结论是该假设不成立.
③乙同学继续查阅文献:Fe(OH)2沉淀具有较强的吸附性能,灰绿色可能是由Fe(OH)2表面吸附Fe2+引起.推测所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好.设计了如下实验方案:
试管中10mL | 滴加 | 实验现象 | |
实验2 | 6mol/L | 0.2mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有少量灰绿色),沉淀下沉后,大部分灰绿色变为白色沉淀 |
实验3 | 6mol/L | 0.1mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有极少量灰绿色),沉淀下沉后,底部都为白色沉淀 |
该实验得出的结论是 , 能说明灰绿色是由Fe(OH)2表面吸附Fe2+引起的证据是 . 丙同学认为该实验方案不足以证明灰绿色是由Fe(OH)2表面吸附Fe2+引起的,还需补充的实验是 , 证明该假设成立.
(3)丙同学探究温度对氢氧化亚铁制备实验的影响:取少量灰绿色沉淀,在水浴中加热,颜色由灰绿变白,且有絮状白色沉淀下沉,原因为 .
(4)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】槟榔碱在医疗上常用于治疗青光眼,其一种合成路线如图: 
已知:Ⅰ.不饱和化合物与氨(NH3)或胺(R﹣NH2)反应能生成新的胺类化合物
如:R1﹣CH=CH2+R2﹣NH2 ![]() R1﹣CH2﹣CH2﹣NH﹣R2
R1﹣CH2﹣CH2﹣NH﹣R2
Ⅱ. ![]() +R3
+R3![]()
![]()
 +R2OH
+R2OH
(1)B中含氧官能团的名称为 .
(2)反应①的反应类型为;反应②的反应条件为 .
(3)反应③的化学方程式为 .
(4)C的结构简式为 .
(5)下列说法正确的是(填字母). a.反应④为取代反应
b.槟榔碱与化合物G互为同系物
c.1mol D最多能与2mol NaOH发生反应
(6)已知A在NaOH溶液中水解的产物之一是一种新型功能高分子材料(PAANa)的单体,写出生成PAANa的化学方程式 .
(7)已知:CH2=CHCH3+Cl2 ![]() CH2=CHCH2Cl+HCl,以丙烯和乙醇为起始原料,选用必要的无机试剂合成A,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件) .
CH2=CHCH2Cl+HCl,以丙烯和乙醇为起始原料,选用必要的无机试剂合成A,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对某品牌牙膏中摩擦剂的成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。利用下图所示装置(夹持仪器略去),对该牙膏样品中碳酸钙的含量进行定量测定。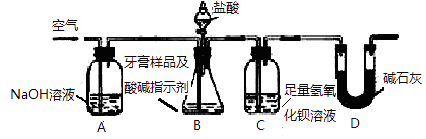
(1)C中反应生成BaCO3的化学方程式是
(2)装置D的作用是
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:
(4)下列各项措施中,不能提高测定准确度的是(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A→B之间增添盛有浓硫酸的洗气装置
d.在B→C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)实验中准确称取10.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g 。则样品中碳酸钙的质量分数为
(6)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:用Pt﹣Rh合金催化氧化NH3制NO,其反应的微观模型及含氮生成物产率随反应温度的变化曲线分别如图①、图②所示:下列说法中,不正确的是( ) 
A.400℃时,生成的产物有N2、NO、H2O
B.800℃时,反应的化学方程式是:4NH3+5O2 ![]() ?4NO+6H2O
?4NO+6H2O
C.400℃﹣800℃间,Pt﹣Rh合金对N2的吸附力逐渐减弱
D.800℃以上,发生了反应:2NO(g)?O2(g)+N2(g)△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)硅酸钠的水溶液俗称 , 向碳酸氢钠溶液中滴入1~2滴酚酞溶液,溶液显色。
(2)Fe(OH)3胶体可用作净水剂,取少量Fe(OH)3胶体于试管中,向试管中逐渐滴加稀盐酸至过量,产生的现象为。
(3)实验室盛装NaOH溶液的试剂瓶不能用玻璃塞,以防止发生反应:(离子方程式)。
(4)将Al和Na的单质同时加入到一定量的水中,充分反应后,发现既无沉淀生成又无残留金属存在,请用两个化学反应方程式表示其变化:
①。
②。
(5)已知:5NH4NO3 ![]() 2HNO3+4N2↑+9H2O,则该反应中氧化产物与还原产物的质量比为。
2HNO3+4N2↑+9H2O,则该反应中氧化产物与还原产物的质量比为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月球含有H、He、N 、Na、Mg、Al、Fe、Si等元素,是人类未来的资源宝库,按要求填空。
(1)Na+结构示意图 , 在Na、Al、Fe三种金属元素中,其所形成氧化物种类最多的元素是 , 所形成的氧化物中适宜做耐火材料的元素是;
(2)月球上某矿石经处理得到的MgO中含有SiO2 , 除去SiO2的离子方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li﹣CuO二次电池的比能量高、工作温度宽,性能优异,广泛应用于军事和空间领域.
(1)Li﹣CuO电池中,金属锂做极.
(2)比能量是指消耗单位质量的电极所释放的电量,用来衡量电池的优劣.比较Li、Na、Al分别作为电极时比能量的大小: .
(3)通过如下过程制备CuO Cu ![]() CuSO4溶液
CuSO4溶液 ![]() Cu2(OH)2CO3沉淀
Cu2(OH)2CO3沉淀 ![]() CuO
CuO
①过程Ⅰ,H2O2的作用是 .
②过程Ⅱ产生Cu2(OH)2CO3的离子方程式是 .
③过程Ⅱ,将CuSO4溶液加到Na2CO3溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如下:
已知:Cu2(OH)2CO3中铜元素的百分含量为57.7%.
二者比值为1:0.8时,产品中可能含有的杂质是 , 产生该杂质的原因是 .
④过程Ⅲ反应的化学方程式是 .
(4)Li﹣CuO二次电池以含Li+的有机溶液为电解质溶液,其工作原理示意如图2.放电时,正极的电极反应式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com