
����Ŀ��Li��CuO���ε�صı������ߡ������¶ȿ����������죬�㷺Ӧ���ھ��ºͿռ�����
��1��Li��CuO����������������
��2����������ָ���ĵ�λ�����ĵ缫���ͷŵĵ���������������ص����ӣ��Ƚ�Li��Na��Al�ֱ���Ϊ�缫ʱ�������Ĵ�С�� ��
��3��ͨ�����¹����Ʊ�CuO Cu ![]() CuSO4��Һ
CuSO4��Һ ![]() Cu2��OH��2CO3����
Cu2��OH��2CO3���� ![]() CuO
CuO
�ٹ��̢�H2O2�������� ��
�ڹ��̢����Cu2��OH��2CO3�����ӷ���ʽ�� ��
�۹��̢�CuSO4��Һ�ӵ�Na2CO3��Һ�У��о����߲�ͬ���ʵ���֮�����Ʒ���ȵĹ�ϵ���òⶨͭԪ�صİٷֺ�����������Ʒ�Ĵ��ȣ���������£�
��֪��Cu2��OH��2CO3��ͭԪ�صİٷֺ���Ϊ57.7%��
���߱�ֵΪ1��0.8ʱ����Ʒ�п��ܺ��е������� �� ���������ʵ�ԭ���� ��
�ܹ��̢�Ӧ�Ļ�ѧ����ʽ�� ��
��4��Li��CuO���ε���Ժ�Li+���л���ҺΪ�������Һ���乤��ԭ��ʾ����ͼ2���ŵ�ʱ�������ĵ缫��Ӧʽ�� ��
���𰸡�
��1����
��2��Li��Al��Na
��3����������2Cu2++2CO32��+H2O�TCu2��OH��2CO3��+CO2����Cu��OH��2����Na2CO3��������ʱ��c��CO32������С��CO32��ˮ��̶ȱ��c��OH����/c��CO32�������ӣ�c��OH�����Բ����Ӱ������Cu2��OH��2CO3 ![]() 2CuO+CO2��+H2O
2CuO+CO2��+H2O
��4��CuO+2e��+2Li+�TCu+Li2O
���������⣺��1��Li��CuO����У�Liʧȥ���ӣ�����������������Դ��ǣ�������2����������ָ���ĵ�λ�����ĵ缫���ͷŵĵ�������������Ϊm���� ![]() ��
�� ![]() ��
�� ![]() ����Li��Na��Al�ֱ���Ϊ�缫ʱ�������Ĵ�СΪLi��Al��Na�� ���Դ��ǣ�Li��Al��Na����3����CuԪ�صĻ��ϼ����ߣ�OԪ�صĻ��ϼ۽��ͣ���H2O2�������������������Դ��ǣ����������ڹ��̢����Cu2��OH��2CO3�����ӷ���ʽ��2Cu2++2CO32��+H2O�TCu2��OH��2CO3��+CO2�������Դ��ǣ�2Cu2++2CO32��+H2O�TCu2��OH��2CO3��+CO2������Cu2��OH��2CO3��ͭԪ�صİٷֺ���Ϊ57.7%�����߱�ֵΪ1��0.8ʱ��CuԪ�صİٷֺ�������57.1%�����ܲ���C�����Ʒ�п��ܺ��е�������Cu��OH��2 �� ��Na2CO3��������ʱ��c��CO32������С��CO32��ˮ��̶ȱ��c��OH����/c��CO32�������ӣ�c��OH�����Բ����Ӱ������
����Li��Na��Al�ֱ���Ϊ�缫ʱ�������Ĵ�СΪLi��Al��Na�� ���Դ��ǣ�Li��Al��Na����3����CuԪ�صĻ��ϼ����ߣ�OԪ�صĻ��ϼ۽��ͣ���H2O2�������������������Դ��ǣ����������ڹ��̢����Cu2��OH��2CO3�����ӷ���ʽ��2Cu2++2CO32��+H2O�TCu2��OH��2CO3��+CO2�������Դ��ǣ�2Cu2++2CO32��+H2O�TCu2��OH��2CO3��+CO2������Cu2��OH��2CO3��ͭԪ�صİٷֺ���Ϊ57.7%�����߱�ֵΪ1��0.8ʱ��CuԪ�صİٷֺ�������57.1%�����ܲ���C�����Ʒ�п��ܺ��е�������Cu��OH��2 �� ��Na2CO3��������ʱ��c��CO32������С��CO32��ˮ��̶ȱ��c��OH����/c��CO32�������ӣ�c��OH�����Բ����Ӱ������
���Դ��ǣ�Cu��OH��2����Na2CO3��������ʱ��c��CO32������С��CO32��ˮ��̶ȱ��c��OH����/c��CO32�������ӣ�c��OH�����Բ����Ӱ�����ܹ��̢�Ӧ�Ļ�ѧ����ʽ��Cu2��OH��2CO3 ![]() 2CuO+CO2��+H2O�����Դ��ǣ�Cu2��OH��2CO3
2CuO+CO2��+H2O�����Դ��ǣ�Cu2��OH��2CO3 ![]() 2CuO+CO2��+H2O����4����Li+���ƶ������֪��CuOΪ������������ԭ��Ӧ����������ӦΪCuO+2e��+2Li+�TCu+Li2O�����Դ��ǣ�CuO+2e��+2Li+�TCu+Li2O��
2CuO+CO2��+H2O����4����Li+���ƶ������֪��CuOΪ������������ԭ��Ӧ����������ӦΪCuO+2e��+2Li+�TCu+Li2O�����Դ��ǣ�CuO+2e��+2Li+�TCu+Li2O��


 �����ߴ���ϵ�д�
�����ߴ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о������Ŷո�ʴ�������ǿ纣���ŵ���Ҫ���⣮�����й��ж�����ȷ���ǣ� �� 
A.��װ�â�ģ���о�ʱδ��a�������ݣ�˵����û�б���ʴ
B.�����Ŷ�����ӵ�Դ����������ȷ���Ŷղ�����ʴ
C.���в������������������������������Ŷ�
D.�٢ڢ��к�ˮ����ʵ�ֻ�ѧ��������ת���ĵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ������ȡSO2����֤SO2ijЩ���ʵ�װ��ͼ�����۲쵽װ�â����е���ɫ�������ɣ����е���ˮ��ɫ����֪����Br2����ˮ�ʺ���ɫ������ش�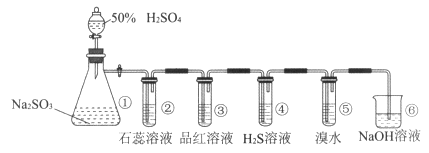
��1�����з�����Ӧ�����ӷ���ʽ����
��2�����е�ʵ����������
��3���۵�ʵ�������� �� ֤��SO2���ԡ�
��4������SO2������
��5�����з�Ӧ��������ǿ�ᣬ�÷�Ӧ�����ӷ���ʽ�� �� ��1 molSO2���뷴Ӧʱ��ת�Ƶ��ӵ����ʵ�������
��6������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����200mLij���ʵ���Ũ�ȵ�NaOH��Һ�л���ͨ��һ������CO2 �� ��ַ�Ӧ����������Һ��pH��7��
��1����ʱ��Һ����������ǵ�һ�ɷ֣�������������Ƕ��ֳɷ֣������� ��
��2��������������Һ�У���λ����μ�2molL��1�����ᣬ�������壨�������ܽ���ˮ�����������������������ϵ��ͼ��ʾ��
�ټ�������200mL֮ǰ�������������д��OA�η�����Ӧ�����ӷ���ʽ ��
��B��ʱ����Ӧ������Һ�����ʵ����ʵ���Ũ��������Һ����ı仯���Բ��ƣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������NO�ķ�ӦΪ��N2��g��+O2��g��2NO��g����t��ʱ��K=0.09����t���¼ס��ҡ������������ܱ������У�Ͷ��N2��g���� O2��g��ģ�ⷴӦ����ʼŨ�������ʾ�������жϲ���ȷ���ǣ� ��
��ʼŨ�� | �� | �� | �� |
c��N2��/molL��1 | 0.46 | 0.46 | 0.92 |
c��O2��/molL��1 | 0.46 | 0.23 | 0.92 |
A.��ʼʱ����Ӧ���ʣ������ף���
B.ƽ��ʱ��c��NO������=������
C.ƽ��ʱ��N2��ת���ʣ��ף���
D.ƽ��ʱ������c��N2��=0.4 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������������Ѫ�ܼ�������Ҫ���������һ�ֺϳ�·����ͼ�� 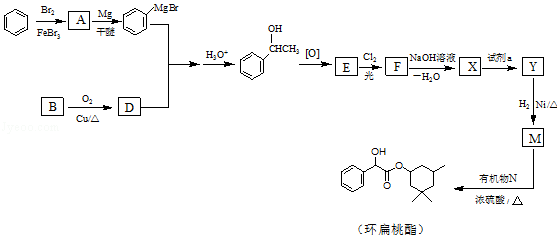
��֪�� 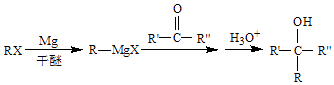 ��R��R�䡢R�������������⣩
��R��R�䡢R�������������⣩
��1��A�Ľṹ��ʽ�� ��
��2��B��D�Ļ�ѧ����ʽ�� ��
��3���������չ��ױ���E��C=O����F�ķ���ʽΪC8H6Cl2O�� ��E�Ľṹ��ʽ�� ��
��E��F�ķ�Ӧ������ ��
��4��X�Ľṹ��ʽ�� ��
��5���Լ�a�� ��
��6�����ɻ��������Ļ�ѧ����ʽ�� ��
��7����CH3CH=CH2��CH3CHOΪ�л�ԭ�ϣ������Ŀ������Ϣ��ѡ�ñ�Ҫ�����Լ��ϳ�CH2=CHCH=CHCH3 �� д���ϳ�·�����ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����д�ʩ�У��������ѧ��Ӧ���ʵ���
A. Zn��ϡ����ķ�Ӧ�У���ZnƬ����Zn��
B. KC103�ķֽⷴӦ�У��ʵ���߷�Ӧ�¶�
C. H202�ķֽⷴӦ�У���������MnO2
D. �ϳɰ��ķ�Ӧ�У�������ϵ����ѹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶����п��淴Ӧ��A��g��+2B��g��2C��g��+D��g�����ֽ�5mol A��10mol B����һ���Ϊ2L���ܱ������У���Ӧ��10minʱ�ı�ijһ������C�����ʵ���Ũ����ʱ��仯��ϵ��ͼ��ʾ�������й�˵����ȷ���ǣ� �� 
A.��0��5min�ڣ�����Ӧ����������
B.��Ӧ����ʼ��5minʱ��B��ת����Ϊ50%
C.5minʱ��ƽ�ⳣ����10minʱ��ƽ�ⳣ������
D.��15minʱ��B���������Ϊ25%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ʵ���Ҽ����ϩ�ͱ������������Ը��������Һ
B. ���顢��ϩ�ͱ�����������ˮ������Ӧ
C. �Ҵ�������ֻ��������ȩ
D. �Ҵ��������������������ķ�Ӧ������ȡ����Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com