
【题目】一定量的稀硫酸与足量的铝粉反应时,为了减缓反应速率,且不影响生成氢气的总量,应向稀硫酸中加入适量的
A.KOH(固体) B.CH3COOH C.KCl(固体) D.CH3COOK(固体)
科目:高中化学 来源: 题型:
【题目】铝及铝合金经过阳极氧化,铝表面能生成几十微米厚的氧化铝膜。某研究性学习小组模拟工业法对铝片表面进行氧化处理,按照如图所示装置连接,电解40min后取出铝片,用水冲洗,放在水蒸气中封闭处理20~30min,即可得到更加致密的氧化膜。下列有关说法正确的是

A.电解时,电子从电源负极→导线→铝极,铅极→导线→电源正极
B.在电解过程中,H+向铝片移动,SO42-向铅片移动
C.电解过程阳极周围溶液的pH下降
D.电解的总反应为2Al+6H+==2Al3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据统计,金属腐蚀造成的损失远远超过火灾、水灾等自然灾害的总和,越来越被世界各国所重视,下面金属的防腐措施中,使用牺牲阳极的阴极保护法的是( )
A. 汽车底盘喷涂油漆 B. 地下钢管连接锌块
C. 钢闸门连接电源负极 D. 掺防腐的金属制成不锈钢菜刀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明缺硒可导致克山病。克山病是一种地方性心肌病,急重症病人可发生猝死。营养学和流行病学界专家认为,成人每天硒的摄取量约在40μg~100μg就可满足人体需要。根据资料,下列解释不正确的是()
A. 硒是人体必需的化学元素
B. 硒在人体生长发育过程中的作用不可替代
C. 硒的作用重大,只要有了硒,人体就能正常生长发育
D. 硒是人体必需的微量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
Ⅱ.[制备产品]实验装置如图所示(省略夹持装置):
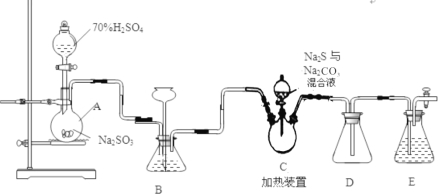
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)(I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)(II)
S(s)+Na2SO3(aq)![]() Na2S2O3(aq)(III)
Na2S2O3(aq)(III)
实验步骤:
①待Na2S和Na2CO3完全消耗后,结束反应。
②向C中烧瓶加入Na2S和Na2CO3混合溶液
③检查装置气密性,按图示加入试剂。
④向A中烧瓶滴加浓H2SO4。
⑤过滤C中混合物,滤液经蒸发、结晶、过滤、洗涤、干燥,得到产品。
(1)E中的试剂是____________(选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)正确的操作顺序是
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,________________ ,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是___________________。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过____________方法提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两项实验:(N2O4![]() 2NO2△H>0)
2NO2△H>0)

(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是
A.(a)甲>乙,(b)甲>乙 B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙 D.(a)甲>乙,(b)甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是
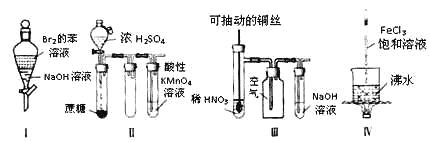
A. 实验Ⅰ:振荡后静置,上层溶液颜色保持不变
B. 实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C. 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验Ⅳ:继续煮沸溶液至红褐色沉淀,停止加热,当光束通过体系时一定不可产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
① 醋酸在水溶液中的电离方程式为 。
② 下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是 (填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
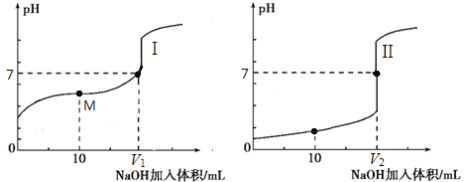
滴定醋酸的曲线是 (填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③ V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1 Fe(NO3)3溶液。 | 溶液变红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 | 现象a ,溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 | 出现黄色沉淀。 |
写出步骤2中溶液变红色的离子方程式 。
步骤3中现象a是 。
用化学平衡原理解释步骤4的实验现象 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯水加热至较高温度,下列叙述正确的是( )
A. 水的离子积变大,pH变小,呈酸性
B. 水的离子积不变,pH不变,呈中性
C. 水的离子积变小,pH变大,呈碱性
D. 水的离子积变大,pH变小,呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com