
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
Ⅱ.[制备产品]实验装置如图所示(省略夹持装置):
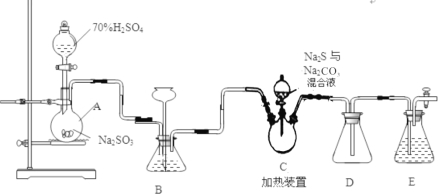
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)(I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)(II)
S(s)+Na2SO3(aq)![]() Na2S2O3(aq)(III)
Na2S2O3(aq)(III)
实验步骤:
①待Na2S和Na2CO3完全消耗后,结束反应。
②向C中烧瓶加入Na2S和Na2CO3混合溶液
③检查装置气密性,按图示加入试剂。
④向A中烧瓶滴加浓H2SO4。
⑤过滤C中混合物,滤液经蒸发、结晶、过滤、洗涤、干燥,得到产品。
(1)E中的试剂是____________(选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)正确的操作顺序是
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,________________ ,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是___________________。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过____________方法提纯。
【答案】
Ⅱ.(1)B;(2)③②④①⑤;(3)C
Ⅲ.(1)过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀HCl(2)先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液;(3)重结晶;
【解析】
试题分析:Ⅱ.(1)E中的试剂是NaOH溶液,目的是吸收剩余的二氧化硫,因为二氧化硫能与氢氧化钠溶液反应,与稀H2SO4和饱和NaHSO3溶液不反应,故答案为:B;
(2)反应中有气体参与,首先检查装置气密性,按图示加入试剂,然后向C中烧瓶加入Na2S和Na2CO3混合溶液,向A中烧瓶滴加浓H2SO4,待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经蒸发、结晶、过滤、洗涤、干燥,得到产品。因此正确的操作顺序为③②④①⑤,故答案为:③②④①⑤;
(3)a.二氧化硫能够溶于水,二氧化硫通过蒸馏水,不能很好的观察SO2的生成速率,错误;b.二氧化硫能够与饱和Na2SO3溶液反应生成亚硫酸氢钠,不能很好的观察SO2的生成速率,错误;c.二氧化硫与饱和NaHSO3溶液不反应,能够观察SO2的生成速率,正确;d.二氧化硫能够与饱和NaHCO3溶液反应放出二氧化碳气体,不能很好的观察SO2的生成速率,错误;故选c;
Ⅲ.(1)根据:Na2S2O35H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl;BaSO4难溶于水,难溶于稀HCl,以及硝酸具有强氧化性、加入硫酸会引入硫酸根离子可知,取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可以确定产品中含有Na2SO3和Na2SO4,故答案为:过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸;
(2)因为亚硫酸钠易被氧化生成硫酸钠,所以为减少装置C中生成Na2SO4的量,改进后的操作是先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液,故答案为:先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液;
(3)Na2S2O35H2O的溶解度随温度升高显著增大,所得产品通过重结晶方法提纯,故答案为:重结晶


科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.反应2CO(g)=2C(s)+O2(g) △H>0可以自发进行
B.放热反应在常温条件下一定很容易进行
C.平衡常数发生变化,化学平衡一定发生移动
D.化学平衡发生移动,平衡常数一定发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】13.0 g Zn与200 mL 1.5 mol·L-1 H2SO4溶液充分反应后,所得溶液中的溶质是______________(填化学式),其中阳离子的物质的量浓度为____________(忽略反应前后溶液体积变化);实验室用氯酸钾和二氧化锰制氧气,______________元素被还原,当有224 mL(标准状况下)O2生成时,电子转移的数目为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是
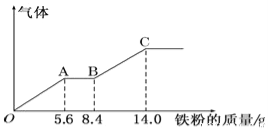
A.H2SO4浓度为2.5mol·L-1
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.原混合酸中NO3-的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸 (H2C2O4)在60℃时反应制得,某学生拟用下图所示的装置模拟制取并收集ClO2。
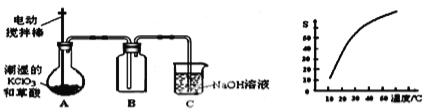
(1)B必须放在冰水浴中控制温度,其原因是_______________。
(2)反应后在装置C中可得NaClO2溶液.已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO23H2O,在温度高于38℃时析出晶体是NaClO2 。根据右上图所示的NaClO2溶解度曲线,请补充从NaClO2溶液中制NaClO2操作步骤:a______;b_______;③洗涤;④干燥。
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
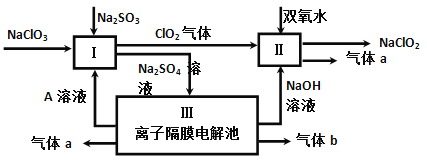
①I、III中发生反应的还原剂分别是_____、_____(填化学式)。
②Ⅱ中反应的离子方程式是___________。
③ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该反应化学方程式______。
④NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+物质的量_______。(填“相同”,“不同”或“无法判断”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的稀硫酸与足量的铝粉反应时,为了减缓反应速率,且不影响生成氢气的总量,应向稀硫酸中加入适量的
A.KOH(固体) B.CH3COOH C.KCl(固体) D.CH3COOK(固体)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,能证明醋酸是弱电解质的是
A. 水溶液的导电能力很弱 B. 溶液中已电离出的离子和未电离的分子共存
C. 能和氢氧化钠溶液反应 D. 熔化状态时不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,1 mol/L醋酸加水稀释至0.01 mol/L,关于稀释前后的下列变化正确的是
A.溶液中c(OH-)减小 B. pH的变化值等于2
C.溶液中![]() 的值增大 D. Kw的值减小
的值增大 D. Kw的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
H2O(g)=H2(g)+1/2O2(g) △H=+241.8kJ/mol
H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol
当1g水蒸气变为液态水时,其热量变化是
A.放热2.44kJ B.吸热2.44kJ C.放热44kJ D.吸热44kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com