
【题目】NaCl晶体中存在的化学键为
A. 共价键 B. 离子键 C. 极性键 D. 非极性键
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】磷及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)少量CO的存在会引起生产中催化剂中毒,常用SO2氧化CO,本身被还原为S。
已知:① Cc(s)+ 1/2O2 (g)=CO (g) △H1=-l26.4kJ·mol-1
②③C(s)+O2 (g) =CO2 (g) △H2=-393.5kJ·mol-1
@S(s)+O2 (g)=SO2 (g) △H3=-296.8kJ·mol-1
则SO2氧化CO的热化学反应方程式__________________。
(2) CO可用于合成甲醇,反应方程式CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
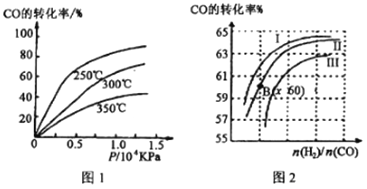
① CO转化率与温度、压强的关系如图所示,该反应△H_______0 (填“>”或“<”)
图2中曲线I、II、III对应的平衡常数分别为K1、K2、K3,则它们的大小关系为___________。测得B(x,60)点氢气的转化率为40%,则x=___________。
②一定条件下,将2molCO和2molH2置于容积为2L固定的密闭容器中发生上述反应,达到平衡时,CO与H2体积之比为2:1,则平衡常数K=___________。
(3)处理高浓度乙醛废水的原理:2CH3CHO+H2O![]() CH3CH2OH+CH3COOH。使用惰性电极电解,以一定浓度的CH3CHO –Na2SO4溶液为电解貭溶液模拟工业处理,其装置如图3所示:
CH3CH2OH+CH3COOH。使用惰性电极电解,以一定浓度的CH3CHO –Na2SO4溶液为电解貭溶液模拟工业处理,其装置如图3所示:
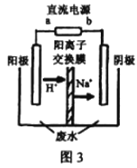
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别:4OH- -4e-=O2↑+2H2O;__________________。
②在实际处现过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入lm3乙醛的含量为300mg L-1的废水,可得到乙醇_______ kg(结果保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答:
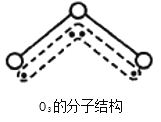
(1)选出下列分子与O3分子的结构最相似的的是___________。
A. H2O B.CO2 C.SO2 D.BeCl2
(2)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有___________对孤对电子。
(3)O3分子是_____________分子(填极性或非极性)。
(4)O3 能使淀粉碘化钾试纸变蓝2KI+O3+H2O===2KOH+I2+O2则氧化产物和还原产物的物质的量之比为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组分析实验室制氯气的方法后认为:MnO2与FeCl3·6H2O共热能产生Cl2,于是设计了下列装置验证该结论。
【查阅资料】FeCl3·6H2O是棕黄色晶体,熔点37℃,沸点280~285℃。
【实验设计】
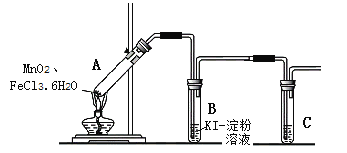
若结论成立,B中发生反应的化学方程式是___,C中的试剂是___。
【实验过程】
操作 | 现象 |
(1)经检查,装置气密性良好。 (2)添加药品,连接装置。 (3)点燃酒精灯。 | i.A中部分固体熔化,上方出现白雾; ii.稍后,产生黄色气体,管壁附着黄色液滴; iii.B中溶液变蓝。 |
【实验分析】
(1)小组讨论一致认为现象i中的白雾是盐酸小液滴,产生白雾的原因是___。
(2)分析现象ii时发生了分歧,有同学认为:FeCl3·6H2O是棕黄色,沸点不高,黄色气体重含有FeCl3也会导致B中溶液变蓝,反应的离子方程式是___。
小组同学通过下列实验证明现象ii的黄色气体中含有Fe3+,将下列实验补充完整:
a.只在A中加入FeCl3·6H2O,加热,开始产生白雾,稍后出现黄色气体,管壁仍有黄色液滴。
b.____________________________________ ,溶液变红。
(3)为进一步确认黄色气体含有 Cl2,小组在A、B 间增加盛有饱和氯化钠溶液的试管,气体依次通过饱和氯化钠溶液、KI淀粉溶液后,KI淀粉溶液变蓝,证实黄色气体中含有Cl2。饱和氯化钠溶液的主要作用是___。
(4)A中固体充分加热后得到Fe2O3和MnCl2,若物质的量之比为1:1,则A中总反应的化学方程式是________。从混合物中分离出Fe2O3的方法是:___。
【安全预案】在实验过程中,若试管B中溶液已经开始发生倒吸,应立即采取的一种措施是___ (填写编号)。
a.移去酒精灯
b.取下B中盛有溶液的试管
c.将A、B间的导管从乳胶管中取出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是 ( )
A. 放热反应在常温下不一定能直接发生
B. 需要加热方能发生的反应一定是吸热反应
C. 反应是放热还是吸热须看反应物和生成物具有的总能量的相对大小
D. 吸热反应在一定条件下也能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4是两种温室气体,研究它们具有重要的意义。
(1)已知CH4、H2和CO的燃烧热(△H)分别为-890.3 kJ· mol-1、-285.8 kJ· mol-1和-283.0 kJ·mol-1。则![]()
![]() △H=_________kJ·mol-1
△H=_________kJ·mol-1
(2)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示为: ![]()
![]() △H=-86.98 kJ·mol-1
△H=-86.98 kJ·mol-1
反应中影响CO2平衡转化率的因素很多,右图为某特定条件下,不同水碳比[n(H2O/n(CO2)]和温度对CO2平衡转化率的影响曲线。

①为提高CO2的平衡转化率,生产中除控制温度外还可以采取的措施有___________________、____________________。
②当温度高于190℃后,CO2平衡转化率出现如图所示的变化趋势,其原因是_______________。
(3)向1.0 L密闭容器中通入0.2 mol NH3(g)和0.1 mol CO2(g),在一定温度下发生反应则![]()
![]() ,反应时间与气体总压强(p)的数据如下表:
,反应时间与气体总压强(p)的数据如下表:
![]() 用起始压强和总压强计算平衡时NH3的转化率为_________,0~80 min内CO2的平均反应速率是__________。
用起始压强和总压强计算平衡时NH3的转化率为_________,0~80 min内CO2的平均反应速率是__________。
(4)氨基甲酸铵(NH2COONH4)极易水解成碳酸铵,在酸性条件水解更彻底。将氨基甲酸铵粉末逐渐加入到1 L 0.1 mol·L-1的盐酸中直到pH=7(室温下,忽略溶液体积变化),共用去0.052 mol氨基甲酸铵,溶液中几乎不含碳元素。此时溶液中c(NH4+)=__________,NH4+水解平衡常数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:一定条件下,在体积为3 L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=__________;根据下图,升高温度,K值将__________(填“增大”、“减小”或“不变”)。
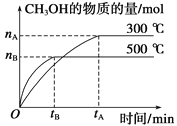
(2)500 ℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是______________(用nB,tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是______(填字母)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(4)300 ℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是________(填字母)。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时c(H2)/c(CH3OH)减小
II:现有可逆反应.2NO2(g) ![]() N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措施。
N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措施。
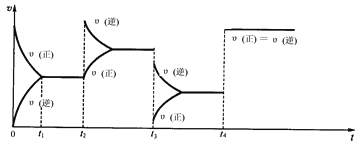
(1)t2:_________________________________________________;
(2)t3:_________________________________________________;
(3)t4:_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com