
����Ŀ��ijѧϰС�����ʵ�����������ķ�������Ϊ��MnO2��FeCl3��6H2O�����ܲ���Cl2���������������װ����֤�ý��ۡ�
���������ϡ�FeCl3��6H2O���ػ�ɫ���壬�۵�37�棬�е�280��285�档
��ʵ����ơ�
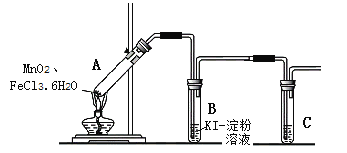
�����۳�����B�з�����Ӧ�Ļ�ѧ����ʽ��___��C�е��Լ���___��
��ʵ����̡�
���� | ���� |
��1������飬װ�����������á� ��2������ҩƷ������װ�á� ��3����ȼ�ƾ��ơ� | i��A�в��ֹ����ۻ����Ϸ����ְ����� ii���Ժ�����ɫ���壬�ܱڸ��Ż�ɫҺ�Σ� iii��B����Һ������ |
��ʵ�������
��1��С������һ����Ϊ����i�еİ���������СҺ�Σ�����������ԭ����___��
��2����������iiʱ�����˷��磬��ͬѧ��Ϊ��FeCl3��6H2O���ػ�ɫ���е㲻�ߣ���ɫ�����غ���FeCl3Ҳ�ᵼ��B����Һ��������Ӧ�����ӷ���ʽ��___��
С��ͬѧͨ������ʵ��֤������ii�Ļ�ɫ�����к���Fe3+��������ʵ�鲹��������
a��ֻ��A�м���FeCl3��6H2O�����ȣ���ʼ�����������Ժ���ֻ�ɫ���壬�ܱ����л�ɫҺ�Ρ�
b��____________________________________ ����Һ��졣
��3��Ϊ��һ��ȷ�ϻ�ɫ���庬�� Cl2��С����A��B ������ʢ�б����Ȼ�����Һ���Թܣ���������ͨ�������Ȼ�����Һ��KI������Һ��KI������Һ������֤ʵ��ɫ�����к���Cl2�������Ȼ�����Һ����Ҫ������___��
��4��A�й����ּ��Ⱥ�õ�Fe2O3��MnCl2�������ʵ���֮��Ϊ1:1����A���ܷ�Ӧ�Ļ�ѧ����ʽ��________���ӻ�����з����Fe2O3�ķ����ǣ�___��
����ȫԤ������ʵ������У����Թ�B����Һ�Ѿ���ʼ����������Ӧ������ȡ��һ����ʩ��___ (��д���)��
a����ȥ�ƾ���
b��ȡ��B��ʢ����Һ���Թ�
c����A��B��ĵ��ܴ��齺����ȡ��
���𰸡� Cl2 +2KI![]() 2KCl + I2 NaOH��Һ FeCl3��6H2O����ˮ����ǿ������HCl����ͬʱʧȥ�ᾧˮ��HCl��H2O����γ�����СҺ�Ρ� 2Fe3++2I-
2KCl + I2 NaOH��Һ FeCl3��6H2O����ˮ����ǿ������HCl����ͬʱʧȥ�ᾧˮ��HCl��H2O����γ�����СҺ�Ρ� 2Fe3++2I-![]() 2Fe2++ I2 ����ɫ����ͨ��B�е�KSCN��Һ�� ��ȥ�����е�FeCl3 MnO2 + 2FeCl3��6H2O
2Fe2++ I2 ����ɫ����ͨ��B�е�KSCN��Һ�� ��ȥ�����е�FeCl3 MnO2 + 2FeCl3��6H2O ![]() Fe2O3 + MnCl2 + Cl2 �� + 2HCl �� + 11H2O ������ˮ�ܽ⣬���ˣ�ϴ�ӹ��壬�������Fe2O3�� C
Fe2O3 + MnCl2 + Cl2 �� + 2HCl �� + 11H2O ������ˮ�ܽ⣬���ˣ�ϴ�ӹ��壬�������Fe2O3�� C
�������� ��������� A������������������⻯�ط�Ӧ�����Ȼ��غ͵ⵥ�ʣ������ж�����Ҫβ��������(1)FeCl3��6H2O����ˮ����ǿ������HCl����ͬʱʧȥ�ᾧˮ����2��Fe3+�������Դ���I2��Fe3+��ʹKSCN��Һ�ʺ�ɫ����3�����������ڱ����Ȼ�����Һ���Ȼ��������ڱ����Ȼ�����Һ����4��A�й����ּ��Ⱥ�õ�Fe2O3��MnCl2������������ԭ��Ӧ����MnCl2��Cl2�ı�Ϊ1:1 �������ʵ���֮��Ϊ1:1����A��������ΪFe2O3��MnCl2��Cl2��HCl�������ܽ��Դӻ�����з����Fe2O3��
��B����Һ�Ѿ���ʼ����������Һ���Ѿ����뵼�ܡ�
������A������������������⻯�ط�Ӧ�����Ȼ��غ͵ⵥ�ʣ���Ӧ����ʽΪCl2 +2KI![]() 2KCl + I2 ��Ϊ��ֹ������Ⱦ������C����NaOH��Һ���ն���������(1)FeCl3��6H2O����ˮ����ǿ������HCl����ͬʱʧȥ�ᾧˮ����������СҺ�Σ����ְ�������2��Fe3+�������Դ���I2������B�з�Ӧ�����ӷ���ʽ��2Fe3++2I-
2KCl + I2 ��Ϊ��ֹ������Ⱦ������C����NaOH��Һ���ն���������(1)FeCl3��6H2O����ˮ����ǿ������HCl����ͬʱʧȥ�ᾧˮ����������СҺ�Σ����ְ�������2��Fe3+�������Դ���I2������B�з�Ӧ�����ӷ���ʽ��2Fe3++2I-![]() 2Fe2++ I2 ������ɫ����ͨ��B�е�KSCN��Һ����KSCN��Һ�ʺ�ɫ������Fe3+����3�����������ڱ����Ȼ�����Һ���Ȼ��������ڱ����Ȼ�����Һ�����Բ����Ȼ�����Һ�������dz�ȥ�����е�FeCl3 ����4��A�й����ּ��Ⱥ�õ�Fe2O3��MnCl2������������ԭ��Ӧ����MnCl2��Cl2�ı�Ϊ1:1 �������ʵ���֮��Ϊ1:1����A��������ΪFe2O3��MnCl2��Cl2��HCl����Ӧ����ʽΪMnO2 + 2FeCl3��6H2O
2Fe2++ I2 ������ɫ����ͨ��B�е�KSCN��Һ����KSCN��Һ�ʺ�ɫ������Fe3+����3�����������ڱ����Ȼ�����Һ���Ȼ��������ڱ����Ȼ�����Һ�����Բ����Ȼ�����Һ�������dz�ȥ�����е�FeCl3 ����4��A�й����ּ��Ⱥ�õ�Fe2O3��MnCl2������������ԭ��Ӧ����MnCl2��Cl2�ı�Ϊ1:1 �������ʵ���֮��Ϊ1:1����A��������ΪFe2O3��MnCl2��Cl2��HCl����Ӧ����ʽΪMnO2 + 2FeCl3��6H2O ![]() Fe2O3 + MnCl2 + Cl2 �� + 2HCl �� + 11H2O��MnCl2������ˮ��Fe2O3������ˮ����������ˮ�ܽ⣬���ˣ�ϴ�ӹ��壬�������Fe2O3��
Fe2O3 + MnCl2 + Cl2 �� + 2HCl �� + 11H2O��MnCl2������ˮ��Fe2O3������ˮ����������ˮ�ܽ⣬���ˣ�ϴ�ӹ��壬�������Fe2O3��
��B����Һ�Ѿ���ʼ����������Һ���Ѿ����뵼�ܣ�Ӧ������ȡ�Ĵ�ʩ�ǽ�A��B��ĵ��ܴ��齺����ȡ����


 �����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧΪ�ⶨά����C��̼���������������ȡά����C��Ʒ���飬��ȡ������0.352 g�����ڲ��۲�����ȼ�չ��У�����ͨ�����������þƾ���Ƴ���������Ʒ�����������Ⱥ�ͨ��Ũ����ͼ�ʯ�ң����߷ֱ�����0.144 g��0.528 g����������ȫ�����ա��Իش��������⣺
��1��ά����C��̼������������_____________�������������____________
��2��ά�������Ƿ�����Ԫ�أ�Ϊʲô��(��ͨ������˵��)
��3�������Ҫ��ȷ��ά����C�ķ���ʽ���㻹��Ҫ��Щ��Ϣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Һ��������������ռ���Һ��װ�� ������ͼ��ʾ������������������Ϊ���Ե缫�����ͬ��ͬѹ�£�������������ҵ������ԼΪ1�U2������˵������ȷ����

A. a�����Դ����������
B. �����Ϊ������Һ
C. ���ӽ���ĤdΪ�����ӽ���Ĥ������������ͨ����
D. a�缫��ӦʽΪ2H2O��2e����2OH���� H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������仯��������
A��Ư��ʹijЩȾ����ɫ B����ˮʹ��ɫ������ɫ
C����������ʹƷ����Һ��ɫ D������̿ʹ��īˮ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���CaF2�ı�����ȷ����
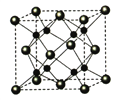
A. Ca2����F��������ھ�����������
B. F�������Ӱ뾶С��Cl������CaF2���۵����CaCl2
C. �������ӱ�Ϊ2��1�����ʣ�����CaF2���幹����ͬ
D. CaF2�еĻ�ѧ��Ϊ���Ӽ������CaF2�ھ���״̬���ܵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʹҩ��˾ƥ�ֵĽṹ��ʽΪ������˵����ȷ����
A. ��˾ƥ�ַ����������9��̼ԭ�Ӵ���ͬһƽ����
B. ��˾ƥ���ܹ�����ȡ����Ӧ���ӳɷ�Ӧ��������Ӧ
C. 1 mol��˾ƥ��������̼��������Һ��Ӧ��������22. 4 L CO2
D. ��˾ƥ���DZ������ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D���ֻ������е���ҩ��е������ϡ����ǵĽṹ��ʽ������ʾ��
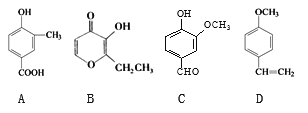
��1��������A�ķ���ʽ��__________��D�к��������ŵ�������____________��
��2��A��B��C��D���ֻ������л�Ϊͬ���칹����ǣ�����ţ�_____________��
��3��������B�ĺ˴Ź��������г���________��壻
��4��1mol C�������________mol�����������ӳɷ�Ӧ��
��5��C�ı����ϵ�һ��ȡ������_________�֡�
��6��д��D�γɵĸ߷��ӻ�����Ľṹ��ʽ��______________��
��7��д��2,3-����-2-��ϩ�ļ���ʽΪ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ������Ԥ����ұ����ѪС��߾ۼ�������ġ��Լ���������ѭ���ϰ�������ҩ���2-�ȱ���ȩΪԭ�Ϻϳɸ�ҩ���·�����£�

��1��A�����С������ԭ����Ŀ���Ϊ________����
��2��C���ж��ֹ����ţ��ܷ������۷�Ӧ����д��C��һ�������¾ۺϳɸ߷��ӻ�����Ļ�ѧ����ʽ____________________��
��3����Eת��Ϊ��������ʱ��������ɵ���һ�ֲ��������Ϊ________��
��4������G������A��ͬϵ���A��һ��̼ԭ�ӣ����ܷ���������Ӧ��������֮����������״�ṹ�����������������G��ͬ���칹�干��______�֡����к˴Ź�����������4�����շ壬�ҷ�ֵ��Ϊ2:2:2:1�Ľṹ��ʽΪ___________����дһ�֣���
��5����֪�� ��д������ϩ���״�Ϊ�л�ԭ���Ʊ�������
��д������ϩ���״�Ϊ�л�ԭ���Ʊ������� �ĺϳ�·������ͼ___________�����Լ���ѡ�����ϳ�·������ͼʾ�����£�
�ĺϳ�·������ͼ___________�����Լ���ѡ�����ϳ�·������ͼʾ�����£�

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com