
【题目】某同学为测定维生素C中碳、氢的质量分数,取维生素C样品研碎,称取该试样0.352 g,置于铂舟并放入燃烧管中,不断通入氧气流。用酒精喷灯持续加热样品,将生成物先后通过浓硫酸和碱石灰,两者分别增重0.144 g和0.528 g,生成物完全被吸收。试回答以下问题:
(1)维生素C中碳的质量分数是_____________,氢的质量分数____________
(2)维生素中是否含有氧元素?为什么?(试通过计算说明)
(3)如果需要你确定维生素C的分子式,你还需要哪些信息?
【答案】(1)40.9%;4.5%;
(2)m(H)=0.144g×![]() ,
,
![]() ,
,
m(H)+m(C)=0.016g+0.144g=0.16g<0.352 g,
所以还含有氧元素;(3)维生素C的相对分子质量
【解析】试题分析:用酒精喷灯持续加热0.352 g维生素C样品,将生成物先后通过浓硫酸和碱石灰,生成物完全被吸收,两者分别增重0.144 g和0.528 g, 那么生成的水的质量为0.144g,生成的CO2的质量为0.528g,
(1)m(H)=0.144g×![]() ,氢元素的质量分数为:
,氢元素的质量分数为:![]() ;
;![]() ,碳元素的质量分数为:
,碳元素的质量分数为:![]() ,答案为:40.9%;4.5%;(2)根据(1)的计算m(H)+m(C)=0.016g+0.144g=0.16g<0.352 g,所以还含有氧元素,答案为:m(H)+m(C)=0.016g+0.144g=0.16g<0.352 g,含有O元素;(3)要确定维生素C的相对分子质量还需要知道维生素C的相对分子质量,答案为:维生素C的相对分子质量
,答案为:40.9%;4.5%;(2)根据(1)的计算m(H)+m(C)=0.016g+0.144g=0.16g<0.352 g,所以还含有氧元素,答案为:m(H)+m(C)=0.016g+0.144g=0.16g<0.352 g,含有O元素;(3)要确定维生素C的相对分子质量还需要知道维生素C的相对分子质量,答案为:维生素C的相对分子质量


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】下列现象或事实不能用同一原理解释的是( )
A.浓硝酸和氯水用棕色试剂瓶保存
B.硫化钠和亚硫酸钠固体长期暴露在空气中变质
C.常温下铁和铂都不溶于浓硝酸
D.SO2和Na2SO3溶液都能使氯水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化学发展史的说法错误的是网]
A. 中国科学家成功合成了结晶牛胰岛素,标志着人类合成蛋白质时代的开始
B. 德国化学家李比希提出运用同位素示踪法研究化学反应历程
C. 瑞典科学家贝采利乌斯提出有机化学的概念,使之成为化学的一个重要分支
D. 德国化学家维勒用氰酸铵合成尿素,从而打破了无机物和有机物的界限
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42﹣完全沉淀,则原溶液中NO3﹣的物质的量浓度为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是

A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)少量CO的存在会引起生产中催化剂中毒,常用SO2氧化CO,本身被还原为S。
已知:① Cc(s)+ 1/2O2 (g)=CO (g) △H1=-l26.4kJ·mol-1
②③C(s)+O2 (g) =CO2 (g) △H2=-393.5kJ·mol-1
@S(s)+O2 (g)=SO2 (g) △H3=-296.8kJ·mol-1
则SO2氧化CO的热化学反应方程式__________________。
(2) CO可用于合成甲醇,反应方程式CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
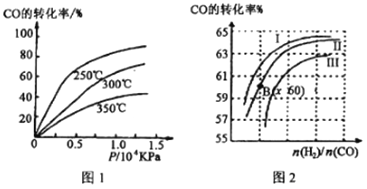
① CO转化率与温度、压强的关系如图所示,该反应△H_______0 (填“>”或“<”)
图2中曲线I、II、III对应的平衡常数分别为K1、K2、K3,则它们的大小关系为___________。测得B(x,60)点氢气的转化率为40%,则x=___________。
②一定条件下,将2molCO和2molH2置于容积为2L固定的密闭容器中发生上述反应,达到平衡时,CO与H2体积之比为2:1,则平衡常数K=___________。
(3)处理高浓度乙醛废水的原理:2CH3CHO+H2O![]() CH3CH2OH+CH3COOH。使用惰性电极电解,以一定浓度的CH3CHO –Na2SO4溶液为电解貭溶液模拟工业处理,其装置如图3所示:
CH3CH2OH+CH3COOH。使用惰性电极电解,以一定浓度的CH3CHO –Na2SO4溶液为电解貭溶液模拟工业处理,其装置如图3所示:
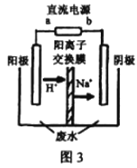
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别:4OH- -4e-=O2↑+2H2O;__________________。
②在实际处现过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入lm3乙醛的含量为300mg L-1的废水,可得到乙醇_______ kg(结果保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】谢弗勒尔盐(Cu2SO3·CuSO3·2H2O)是一种深红色固体,不溶于水和乙醇,100℃时发生分解。可由CuSO4·5H2O和SO2等为原料制备,实验装置如下图所示:

(1)装置A在常温下制取SO2时,用较浓的硫酸而不用稀硫酸,其原因是_______________。
(2)装置B中发生反应的离子方程式为_______________。
(3)装置C的作用是____________________。
(4)从B中获得的固体需先用蒸馏水充分洗涤,再真空干燥。
①检验洗涤已完全的方法是__________________。
②不用烘干的方式得到产品,其原因是________________。
(5)请补充完整由工业级氧化铜(含少量FeO)制备实验原料(纯净CuSO4·5H2O)的实验方案:向工业级氧化铜中边搅拌边加入稍过量的硫酸溶液,微热使其完全溶解,_______________,过滤,用95%酒精洗涤晶体2~3次,晾干,得到CuSO4·5H2O。
[已知:①该溶液中氢氧化物开始沉淀与沉淀完全时的pH范围分别为:Fe(OH)2(5.8,8.8);Cu(OH)2(4.2,6.7);Fe(OH)3(1.1,3.2)。②在水溶液中超过100℃,硫酸铜晶体易失去结晶水。③硫酸铜晶体溶解度曲线如右图所示]

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组分析实验室制氯气的方法后认为:MnO2与FeCl3·6H2O共热能产生Cl2,于是设计了下列装置验证该结论。
【查阅资料】FeCl3·6H2O是棕黄色晶体,熔点37℃,沸点280~285℃。
【实验设计】
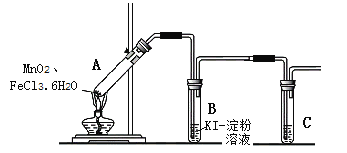
若结论成立,B中发生反应的化学方程式是___,C中的试剂是___。
【实验过程】
操作 | 现象 |
(1)经检查,装置气密性良好。 (2)添加药品,连接装置。 (3)点燃酒精灯。 | i.A中部分固体熔化,上方出现白雾; ii.稍后,产生黄色气体,管壁附着黄色液滴; iii.B中溶液变蓝。 |
【实验分析】
(1)小组讨论一致认为现象i中的白雾是盐酸小液滴,产生白雾的原因是___。
(2)分析现象ii时发生了分歧,有同学认为:FeCl3·6H2O是棕黄色,沸点不高,黄色气体重含有FeCl3也会导致B中溶液变蓝,反应的离子方程式是___。
小组同学通过下列实验证明现象ii的黄色气体中含有Fe3+,将下列实验补充完整:
a.只在A中加入FeCl3·6H2O,加热,开始产生白雾,稍后出现黄色气体,管壁仍有黄色液滴。
b.____________________________________ ,溶液变红。
(3)为进一步确认黄色气体含有 Cl2,小组在A、B 间增加盛有饱和氯化钠溶液的试管,气体依次通过饱和氯化钠溶液、KI淀粉溶液后,KI淀粉溶液变蓝,证实黄色气体中含有Cl2。饱和氯化钠溶液的主要作用是___。
(4)A中固体充分加热后得到Fe2O3和MnCl2,若物质的量之比为1:1,则A中总反应的化学方程式是________。从混合物中分离出Fe2O3的方法是:___。
【安全预案】在实验过程中,若试管B中溶液已经开始发生倒吸,应立即采取的一种措施是___ (填写编号)。
a.移去酒精灯
b.取下B中盛有溶液的试管
c.将A、B间的导管从乳胶管中取出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com