
【题目】有一种有机物,因其酷似奥林匹克旗中的五环(如图),科学家称其为奥林匹克烃,下列有关奥林匹克烃的说法正确的是
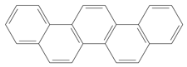
A.该烃的一氯代物只有一种
B.该烃分子中只含非极性键
C.该烃完全燃烧生成H2O的物质的量小于CO2的物质的量
D.该烃属于苯的同系物
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
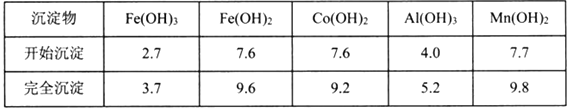
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
④CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴。
请回答:
(1)“加Na2CO3调pH至5.2”,过滤所得到的沉淀Ⅹ成分为___________。
(2)萃取剂对金属离子的萃取率与pH的关系如图所示,萃取剂使用的适宜pH范围是___________。(填选项序号字母)
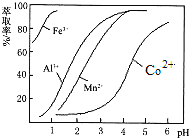
A 1.0~2.0 B 2.5~3.5 C 4.0~5.0
(3)为测定粗产品中CoCl2·6H2O含量,称取2g的粗产品溶于水,配成100mL溶液,取出20mL置于锥形瓶,加入K2CrO4做指示剂( Ag2CrO4为砖红色沉淀),用0.2mol/L的AgNO3溶液滴定至终点,重复2-3次,平均消耗AgNO3标准溶液10.00mL。该粗产品中CoCl2·6H2O的质量分数为___________。用K2CrO4做指示剂时,需要控制溶液pH值为6.5~10.5,试分析原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
D. CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.1000 mol·L-1盐酸滴入20.00 mL 0.100 0mol·L-1的某一元碱MOH溶液中,溶液的pH随加入盐酸体积变化曲线如下图所示。下列有关说法不正确的是( )

A.该一元碱的电离方程式为MOH = M++OH-
B.a、b、c三点中,b点水的电离程度最大
C.室温下,MOH的电离常数Kb=1×10-5 mol·L-1
D.b点:c (M+)=c (Clˉ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某有机物A的结构简式如右图,请按要求写出相应产物的结构简式
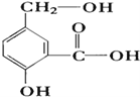
①A跟NaOH溶液反应 ____________________________;
②A跟NaHCO3溶液反应 _________________________________;
③A跟Na反应 _______________________。
(2)丙酸丙酯是一种香料,可以用下面的方案合成:![]()
①写出A,B,C,D的结构简式:
A ____________B_____________C_____________D_______________
②D有很多同分异构体,其中含有羧基的同分异构体中,烃基上的一氯代物有2种的结构简式为________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验淀粉水解的产物,设计如下实验方案:
![]()
请回答下列问题:
(1)试剂1为20%的H2SO4溶液,其作用是_________;
(2)试剂2为_________NaOH溶液,其作用是_________,使检验水解产物的实验得以顺利进行;发生反应的离子方程式为:_________;
(3)反应①的化学方程式为_________;
(4)为检验淀粉液是否已完全水解,取少量水解液于试管中,加入碘水,则证明淀粉未完全水解的现象是_________;
(5)如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的_________(填”能”或”否”)否,若不能,其原因是_________硫酸能溶解Cu(OH)2而使实验失败,最简单的改正措施是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3COOH、H2SO3是中学化学中常见的弱酸,请回答下列问题:
(1)常温下,下列叙述能证明CH3COOH为弱酸是_________。
a. CH3COONa 溶液的pH大于7;
b.相同体积相同浓度的盐酸和醋酸溶液,分别与足量锌粉反应,放出相同体积的氢气;
c.相同体积、相同pH的盐酸和醋酸,醋酸中和NaOH的物质的量多;
d.0.01mol/L的CH3COOH溶液,PH > 2
(2)常温下,向0.1 mol·L-1 CH3COOH溶液中加蒸馏水稀释,稀释后,下列各量增大的是_________:
a.![]() b.
b.![]() c.c(OH-)
c.c(OH-)
(3)将浓度均为0.1mol/LCH3COOH和CH3COONa溶液等体积混合,测得混合液中c(CH3COO-)>c(Na+),则下列关系式中正确的是(_____)
A.c(H+) > c(OH-) B.c(H+) < c(OH-)
C.c(CH3COOH) > c(CH3COO-) D.c(CH3COOH) + c(CH3COO-)=0.1mol/L
(4)若等体积等物质的量浓度的醋酸和氢氧化钠溶液混合,溶液呈_______(填“酸性”,“中性”或“碱性”),原因是 _______________(用离子方程式表示)。若将pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈__________(填“酸性”,“中性”或“碱性”),溶液中c(Na+) ___________c(CH3COO-) (填“ >” 或“=”或“<” )。
(5)25℃时,H2SO3的电离常数Ka1=1×10-2mol/L,Ka2=6×10-3mol/L,则该温度下NaHSO3的水解平衡常数Kh=__________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
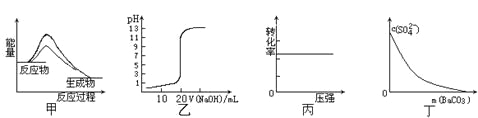
A.图甲表示使用催化剂后,该反应的ΔH变小
B.图乙表示0.10mol·L-1NaOH溶液滴定20.00mL0.10mol·L-1CH3COOH溶液所得到的滴定曲线
C.图丙表示反应H2(g) + I2(g)![]() 2HI(g)中H2的转化率随压强的变化
2HI(g)中H2的转化率随压强的变化
D.图丁表示在饱和Na2SO4溶液中逐步加BaCO3固体后,溶液中c(SO42-)的浓度变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0 L真空密闭容器中充入4.0 mol A(g)和4.0 mol B(g),在一定温度下进行反应:A(g)+B(g)![]() C(g) ΔH,测得不同时刻该容器内物质的物质的量如下表:
C(g) ΔH,测得不同时刻该容器内物质的物质的量如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(A)/mol | 4.0 | 2.5 | 1.5 | n2 | n3 |
n(C)/mol | 0 | 1.5 | n1 | 3 | 3 |
回答下列问题:
(1)随着温度的升高,该反应的化学平衡常数减小,则ΔH__________(填“>”“<”或“=”)0,反应从起始到20 min内C的平均反应速率是________。
(2)该温度下,上述反应的化学平衡常数为________。平衡时体系内气体的总压强是反应起始时总压强的________。
(3)下列选项中能说明该反应在一定温度和恒容条件下达到平衡状态的是________。
A.反应速率:vA(正)+vB(正)=vC(逆)
B.A的质量不再改变
C.B的转化率不再改变
D.密度不再改变
(4)若反应C(g)![]() A(g)+B(g) ΔH>0,进行时需加入稀释剂X气体(不参与反应),则C的平衡转化率与体系的温度、压强、X的物质的量的关系如图1、图2所示。
A(g)+B(g) ΔH>0,进行时需加入稀释剂X气体(不参与反应),则C的平衡转化率与体系的温度、压强、X的物质的量的关系如图1、图2所示。


①由图1可知,T1________(填“>”“<”或“=”)T2。
②由图2可知,当其他条件不变时,增大X的物质的量,C的平衡转化率将________(填“增大”“减小”或“不变”),其原因是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com