
����Ŀ�������£���0.1000 mol��L��1�������20.00 mL 0.100 0mol��L��1��ijһԪ��MOH��Һ�У���Һ��pH�������������仯��������ͼ��ʾ�������й�˵������ȷ����( )

A.��һԪ��ĵ��뷽��ʽΪMOH �� M+��OH��
B.a��b��c�����У�b��ˮ�ĵ���̶����
C.�����£�MOH�ĵ��볣��Kb��1��10��5 mol��L��1
D.b�㣺c (M+)��c (Cl��)
���𰸡�A
��������
A. ����ͼ��0.100 0mol��L��1��һԪ��MOH��pH=11����c(OH-)=0.001mol/L,��һԪ��Ϊ�������뷽��ʽΪMOHM+��OH�����������⣬A��ȷ��
B. ����ͼ��aΪ���������Һ��b����Һ�����ԣ�cΪ���������Һ���ᡢ���ˮ�ĵ������������ã��������У�b��ˮ�ĵ���̶���������ⲻ����B����
C. �����£�MOH�ĵ��볣��Kb��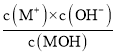 =
=![]() =1��10��5 mol��L��1�������ⲻ����C����
=1��10��5 mol��L��1�������ⲻ����C����
D. b����Һ�����ԣ���c(H+)��c(OH-)��������Һ�ʵ����ԣ�c (M+)+ c(H+)��c (Cl��)+c(OH-)���õ�c (M+)��c (Cl��)�������ⲻ����D����
��ΪA��


 �Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�
�Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�ͼ������ȷ����![]()

A.�ױ�ʾ![]() ��
��![]() ������Ӧ�����е������仯��
������Ӧ�����е������仯��![]() ��ȼ����Ϊ
��ȼ����Ϊ![]()
B.�ұ�ʾ���º��������·�Ӧ![]() �У������ʵ�Ũ����������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬
�У������ʵ�Ũ����������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬
C.����ʾA��B�����ʵ��ܽ�����¶ȱ仯�������![]() ʱA��B�ı�����Һ�ֱ�������
ʱA��B�ı�����Һ�ֱ�������![]() ʱ�����ʵ���������
ʱ�����ʵ���������![]()
D.����ʾ�����£���![]() �������
�������![]()
![]() ��ˮ�У���ҺpH���¶��������������仯����
��ˮ�У���ҺpH���¶��������������仯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ����ȷ����
A.����Ӧ2AB(g)C(g)+3D(g)�ڸ��������Է����У����淴Ӧ�ڵ��������Է����У��������Ӧ��H������S����
B.��101KPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ���������ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪ2H2(g)+O2(g)=2H2O(l) H=-571.6kJ/mol
C.һ�������£���Ӧ2SO2(g)+O2(g)=2SO3(g)H�����ﵽƽ���������ϵ�¶ȷ�Ӧ���´ﵽƽ��ǰ����2v��(O2)��v��(SO3)
D.�����ǡ����ȫ��Ӧ�������ε�c(H+)=c(OH-)=10-6mol/L����Һһ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����ʯ��ʯī��Ϊ̼��ͬ�������壬��������������ʱȼ������һ����̼������������ʱ���ȼ�����ɶ�����̼����Ӧ�зų���������ͼ��ʾ��
a.��ͨ��״���£����ʯ��ʯī��Ƚ�_____�����������ʯ������ʯī�������ȶ���ʯī��ȼ����Ϊ_____��
b.12gʯī��һ����������ȼ�գ���������36g���ù��̷ų�������Ϊ_____��
��2����֪��N2��O2�����л�ѧ���ļ��ֱܷ���946kJmol��1��497kJmol��1��N2��g��+O2��g���T2NO��g����H��+180.0kJ��mol��1��NO�����л�ѧ���ļ���Ϊ_____kJ��mol��1��
��3���ۺ������й���Ϣ����д����CO��ȥNO���Ȼ�ѧ����ʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
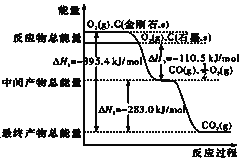
����Ŀ���շ���͡��һ�ֵ���Ѫ֬��ҩ���ṹ����ͼ��ʾ��δ��ʾ����ռ乹�ͣ������й����շ���͡������������ȷ����
A. ����FeCl3��Һ������ɫ��Ӧ
B. ��ʹ����KMnO4��Һ��ɫ
C. 1mol�������������Ʒ�����Ӧ����4molH2
D. 1mol������������1molNaOH��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
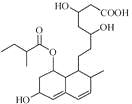
����Ŀ�������ᣨ��ͼ����������������ҩ����Ұ���ܲ�����Ҷˮ�ա�������У���������ֹ Ѫ���ã����й��ڿ������˵������ȷ���ǣ� ��

A. ������ķ���ʽΪC9H8O4
B. 1mol��������Ժͺ�4molBr2��Ũ��ˮ��Ӧ
C. 1mol��������Ժ�3molNaOH��Ӧ
D. �����ø�����ؼ��������������к���̼̼˫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���л��������ư���ƥ�����е��廷(��ͼ)����ѧ�ҳ���Ϊ����ƥ�����������йذ���ƥ������˵����ȷ����
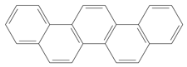
A.������һ�ȴ���ֻ��һ��
B.����������ֻ���Ǽ��Լ�
C.������ȫȼ������H2O�����ʵ���С��CO2�����ʵ���
D.�������ڱ���ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ��Һ�е����Ҷ���(H2N��CH2��CH2��NH2)�����γ�������A����ṹ��ͼ��

(1)��̬��Cu2+��������Ų�ʽΪ________��
(2)Ԫ��C��N��O�ĵ�һ�������ɴ�С����˳��Ϊ_______��![]() �Ŀռ乹��Ϊ________��
�Ŀռ乹��Ϊ________��
(3)A�����γɵ��������к��еĻ�ѧ��������__________(����)��
a.��λ�� b.���Լ� c.���Ӽ� d.�Ǽ��Լ�
(4)�Ҷ��������е�ԭ�ӹ�����ӻ�����Ϊ___________���Ҷ��������װ� [N(CH3)3]�����ڰ������Ҷ��������װ��ķе�ߵĶ࣬ԭ����________��
(5)����ͭ���տ�������һ�ֺ�ɫ���壬��ṹ��ͼ��ʾ����û�����Ļ�ѧʽ��____����֪������ܶ�Ϊ��g��cm-3�������ӵ�����ΪNA�����߳�a=______cm��(�ú�����NA�ļ���ʽ��ʾ)

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и�������һ������ָ����Һ�д���������ǣ� ��
A. ʹ��̪���ɫ����Һ�У�Na����Al3����SO42����Cl��
B. ![]() =1��10��13mol��L��1����Һ�У�NH4����Ca2����Cl����NO3��
=1��10��13mol��L��1����Һ�У�NH4����Ca2����Cl����NO3��
C. ��Al��Ӧ�ܷų�H2����Һ�У�Fe2����K����NO3����SO42��
D. ˮ�����c(H��)=1��10��13mol��L��1����Һ�У�K����Na����AlO2����CO32��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com