
【题目】(1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.
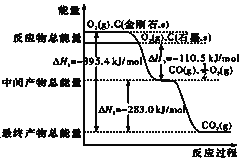
a.在通常状况下,金刚石和石墨相比较_____,(填”金刚石”或”石墨”)更稳定,石墨的燃烧热为_____.
b.12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为_____.
(2)已知:N2、O2分子中化学键的键能分别是946kJmol﹣1、497kJmol﹣1.N2(g)+O2(g)═2NO(g)△H=+180.0kJ·mol﹣1.NO分子中化学键的键能为_____kJ·mol﹣1.
(3)综合上述有关信息,请写出用CO除去NO的热化学方程式:_____.
【答案】石墨 ﹣393.5kJmol﹣1 252.0 kJ 631.5 2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=﹣746.0kJmol﹣1
【解析】
(1)(a)图象分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,图象分析1mol石墨完全燃烧生成1mol二氧化碳放出的热量为393.5kJ,则石墨的燃烧热为△H=﹣393.5kJmol﹣1;
故答案为:石墨;﹣393.5kJmol﹣1;
(b)12g石墨物质的量为1mol,在一定量空气中燃烧,依据元素守恒,若生成二氧化碳质量为44g,若生成一氧化碳质量为28g,生成气体36g,28g<36g<44g,判断生成的气体为一氧化碳和二氧化碳气体,设一氧化碳物质的量为x,二氧化碳物质的量为(1﹣x)mol,28x+44(1﹣x)=36g,x=0.5mol,二氧化碳物质的量为0.5mol;依据图象分析,C(石墨,s)+O2(g)═CO2(g)△H=﹣393.5 kJmol﹣1 ;C(石墨,s)![]() O2(g)═CO(g)△H=﹣110.5 kJmol﹣1
O2(g)═CO(g)△H=﹣110.5 kJmol﹣1
生成二氧化碳和一氧化碳混合气体放出热量=393.5 kJmol﹣1 ×0.5mol+110.5 kJmol﹣1 ×0.5mol=252kJ;12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252.0kJ;
故答案为:252.0 kJ;
(2)△H=反应物键能和﹣生成物键能和,946kJ/mol+497kJ/mol﹣2Q(N﹣O)=180.0kJ/mol,Q(N﹣O)=631.5kJ/mol,故答案为:631.5;
(3)已知①C(石墨,s)+O2(g)=CO2(g)△H=﹣393.5 kJmol﹣1;
②C(石墨,s)![]() O2(g)=CO(g)△H=﹣110.5 kJmol﹣1;
O2(g)=CO(g)△H=﹣110.5 kJmol﹣1;
③N2(g)+O2(g)=2NO(g)△H=+180kJmol﹣1;
由盖斯定律:方程式①×2﹣②×2﹣③得 2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=﹣746.0kJmol﹣1;
故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=﹣746.0kJmol﹣1;


科目:高中化学 来源: 题型:
【题目】(1)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈________(填“酸性”“中性”或“碱性”)。
(2)25℃时,将m mol·L-1的醋酸和n mol·L-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=________,m与n的大小关系是m________n(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。实验室利用下图装置制备亚硝酸钠,并测定所制亚硝酸钠的纯度。(加热装置及部分夹持装置已略去)
Ⅱ.亚硝酸钠纯度的测定。
当Na2O2完全反应后,E中产生的固体除NaNO2外,还可能有NaNO3。测定亚硝酸钠纯度的步骤如下:
步骤一:取反应后的固体4.30 g溶于稀硫酸,向所得溶液中加入足量KI,将溶液中的NO2-和NO3-全部还原为NO,并通入足量N2,将NO全部赶出,最后将溶液稀释至1000 mL。
步骤二:取上述所得溶液10 mL,用淀粉作指示剂,用0.050 mol/L的Na2S2O3标准液滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,最终消耗Na2S2O3溶液体积为16.00 mL。
(1)步骤二中达到滴定终点的标志为______________________。
(2)混合固体中NaNO2的质量分数为________。(保留三位有效数字)
(3)若在滴定终点读取滴定管刻度时,仰视标准液液面,则测得亚硝酸钠的纯度________。(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于纸浆漂白、水处理等;工业上生产NaClO2有多种方法,某工业生产的流程如图所示:
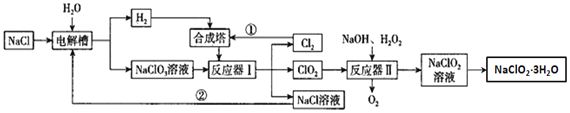
请回答下列问题:
为了测定NaClO2·3H2O的纯度,取上述合成产品10g溶于水配成500mL溶液,取出10mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后加入2~3滴淀粉溶液,用0.264mol/LNa2S2O3标准液滴定,锥形瓶中溶液___(填颜色变化),且半分钟内不发生变化,说明滴定达终点,用去标准液20.00mL,试样纯度是否合格___(填“合格”或“不合格”,合格纯度在90%以上)。提示:2Na2S2O3+I2=Na2S4O6+2NaI。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
D. CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在容积为2L的密闭容器中,将2 mol 气体M和3 mol N气体混合,发生如下反应:2M(g) + 3N(g) ![]() x Q(g) +3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
x Q(g) +3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
A. x值为2 B. 混合气体的密度增大
C. N的转化率为20% D. 平衡时N的浓度为0.3 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.1000 mol·L-1盐酸滴入20.00 mL 0.100 0mol·L-1的某一元碱MOH溶液中,溶液的pH随加入盐酸体积变化曲线如下图所示。下列有关说法不正确的是( )

A.该一元碱的电离方程式为MOH = M++OH-
B.a、b、c三点中,b点水的电离程度最大
C.室温下,MOH的电离常数Kb=1×10-5 mol·L-1
D.b点:c (M+)=c (Clˉ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验淀粉水解的产物,设计如下实验方案:
![]()
请回答下列问题:
(1)试剂1为20%的H2SO4溶液,其作用是_________;
(2)试剂2为_________NaOH溶液,其作用是_________,使检验水解产物的实验得以顺利进行;发生反应的离子方程式为:_________;
(3)反应①的化学方程式为_________;
(4)为检验淀粉液是否已完全水解,取少量水解液于试管中,加入碘水,则证明淀粉未完全水解的现象是_________;
(5)如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的_________(填”能”或”否”)否,若不能,其原因是_________硫酸能溶解Cu(OH)2而使实验失败,最简单的改正措施是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是

A.图甲表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
B.图乙是金刚石与石墨分别氧化生成CO2的能量关系曲线,说明石墨转化为金刚石的反应的ΔH>0
C.图丙表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点
D.图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com