
【题目】(亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。实验室利用下图装置制备亚硝酸钠,并测定所制亚硝酸钠的纯度。(加热装置及部分夹持装置已略去)
Ⅱ.亚硝酸钠纯度的测定。
当Na2O2完全反应后,E中产生的固体除NaNO2外,还可能有NaNO3。测定亚硝酸钠纯度的步骤如下:
步骤一:取反应后的固体4.30 g溶于稀硫酸,向所得溶液中加入足量KI,将溶液中的NO2-和NO3-全部还原为NO,并通入足量N2,将NO全部赶出,最后将溶液稀释至1000 mL。
步骤二:取上述所得溶液10 mL,用淀粉作指示剂,用0.050 mol/L的Na2S2O3标准液滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,最终消耗Na2S2O3溶液体积为16.00 mL。
(1)步骤二中达到滴定终点的标志为______________________。
(2)混合固体中NaNO2的质量分数为________。(保留三位有效数字)
(3)若在滴定终点读取滴定管刻度时,仰视标准液液面,则测得亚硝酸钠的纯度________。(填“偏高”“偏低”或“无影响”)
【答案】滴入最后一滴标准液后,溶液由蓝色褪为无色,且30 s内不再变化 80.2%(80.0%~80.3%即可) 偏低
【解析】
(1)碘遇淀粉变蓝,碘单质消失则蓝色消失;
(2)根据反应方程式,结合物料守恒,计算混合固体中NaNO2的质量分数;
(3)根据c(待)=![]() 分析亚硝酸钠的纯度;
分析亚硝酸钠的纯度;
(1)步骤二中以淀粉作指示剂,当达到滴定终点时,再滴入最后一滴标准液时,溶液由蓝色褪为无色,且30s内不再变化;
(2)步骤一将混合固体溶于稀硫酸,向所得溶液中加入足量KI,发生的反应方程式为4H++2NO2-+2I-=2NO↑+I2+2H2O和8H++2NO3-+6I-=2NO↑+3I2+4H2O,滴定过程发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,根据物料守恒,反应中Na2S2O3与I2的化学计量比为2∶1、I2与NO2-的化学计量比为1∶2、I2与NO3-反应的化学计量比为3∶2,则Na2S2O3与NO2-的化学计量比为1∶1、Na2S2O3与NO3-的化学计量比为3∶1,滴定消耗n(Na2S2O3)=0.050 mol·L-1×0.016 L=8.0×10-4 mol,设混合固体中NaNO2的质量分数为x,根据物料守恒得n(NaNO2)+3n(NaNO3)=n(Na2S2O3),则![]() mol=
mol=![]() ×8.0×10-4mol,解得x=0.802,所以混合固体中NaNO2的质量分数为80.2%(80.0%~80.3%即可);
×8.0×10-4mol,解得x=0.802,所以混合固体中NaNO2的质量分数为80.2%(80.0%~80.3%即可);
(3)若在滴定终点读取滴定管刻度时,仰视标准液液面,则滴定读数偏大,计算所得硝酸钠偏多,则测得亚硝酸钠的纯度偏低。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】TiO2广泛应用于涂料、塑料、造纸、印刷油墨等领域。TiOSO4溶液加水稀释可析出aTiO2·bH2O沉淀。
(1)写出TiOSO4溶液加水稀释时所发生反应的化学方程式:____。
(2)实验室测定aTiO2·bH2O组成的方法如下:
步骤一:取样品4.900 g,在酸性条件下充分溶解,加入适量铝将溶解生成的TiO2+还原为Ti3+,将溶液转移到容量瓶中,并定容至250 mL。
步骤二:取25.00 mL定容后的溶液于锥形瓶中,加入KSCN溶液作指示剂,用0.2000mol·L-1的NH4Fe(SO4)2 标准溶液滴定,将实验数据记录在下表中。重复滴定2次。滴定过程发生的物质转化为:Ti3+![]() TiO2+
TiO2+
滴定序号 | 待测液体积/mL | NH4Fe(SO4)2标准溶液 | |
滴定管起点读数/mL | 滴定管终点读数/mL | ||
1 | 25.00 | 0.04 | 25.04 |
2 | 25.00 | 0.07 | 25.05 |
3 | 25.00 | 0.13 | 25.15 |
①使用滴定管过程中所涉及下列操作的先后顺序是____(填字母)。
a.排除滴定管尖嘴处的气泡 b.检查滴定管是否漏液 c.用待装液润洗滴定管
②滴定终点的实验现象是____。
③通过计算确定该样品的组成,写出计算过程____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图叙述正确的是![]()

A.甲表示![]() 与
与![]() 发生反应过程中的能量变化,
发生反应过程中的能量变化,![]() 的燃烧热为
的燃烧热为![]()
B.乙表示恒温恒容条件下反应![]() 中,各物质的浓度与其速率之间的关系,其中交点A对应的状态为化学平衡状态
中,各物质的浓度与其速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将![]() 时A、B的饱和溶液分别升温至
时A、B的饱和溶液分别升温至![]() 时,溶质的质量分数
时,溶质的质量分数![]()
D.丁表示室温下,将![]() 盐酸滴入
盐酸滴入![]()
![]() 氨水中,溶液pH和温度随加入盐酸体积变化曲线
氨水中,溶液pH和温度随加入盐酸体积变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(l)△H=﹣483.6 kJmol﹣1,则氢气的燃烧热为483.6 kJmol﹣1
B. 在一定温度和压强下,将0.5mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3 kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=﹣19.3kJ/mol
2NH3(g) △H=﹣19.3kJ/mol
C. 已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2 则△H1>△H2
D. 已知Ni(CO)4(s)=Ni(s)+4CO(g) △H=Q kJmol﹣1,则Ni(s)+4CO(g)=Ni(CO)4(s) △H=﹣Q kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物在化学工业中有着重要的应用,回答下列问题:
(1)一定条件下,硝酸铵加热分解得到的产物只有N2O和H2O。250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的平衡常数表达式为K=___________;若有1mol硝酸铵完全分解,则转移电子的数目为___________(设NA为阿伏加德罗常数的值)。
(2)硝基苯甲酸乙酯在碱性条件下发生反应:O2NC6H4COOC2H5+OH-![]() O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
t/s | 0 | 60 | 90 | 120 | 160 | 260 | 300 | 360 | 400 |
a/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
①该反应在60~90s与90~120s内的平均反应速率分别约为___________,___________;比较两者大小可得出的结论是______________________。
②计算T℃时该反应的平衡常数为______________________。
③为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施为______________________(写出一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
Ⅰ.室温下,现有c(H+) 相同的醋酸甲和盐酸乙:
(1)相同条件下,取等体积的甲乙两溶液,各稀释100倍。稀释后的溶液,其c(H+) 大小关系为:
甲 _____________乙 (填“大于”“小于”或“等于”,下同)。
(2)各取25 mL的甲乙两溶液,分别与等浓度的NaOH稀溶液完全反应,则消耗的NaOH溶液的体积大小关系为V(甲) _____________ V(乙)。
Ⅱ.已知25 ℃时有关弱酸的电离平衡常数如下:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
(1)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
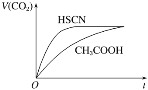
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 _____________。
(2)若保持温度不变,在醋酸溶液中通入一定量氨气,下列各量会变小的是 ______________(填字母)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
III.(1)HClO4H2SO4HCl和HNO3都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数,下列说法不正确的是 _________。
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | Ka1:6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
A.温度会影响这四种酸在冰醋中的电离常数
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4===2H++SO42-
D.这四种酸在冰醋酸中都没有完全电离,但仍属于强电解质
(2)亚磷酸是二元中强酸,25 ℃时亚磷酸(H3PO3)的电离常数为K1=1×10-2K2=2.6×10-7。
①试从电离平衡移动的角度解释K1为什么比K2大_______________________ 。
②写出亚磷酸的电离方程式(2步)_________________;_______________ 。
③请设计一种方案,使之能通过直观的实验现象判断醋酸的酸性强于H2S,该方案所用的试剂是 __________,反应的化学方程式为 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示法正确的是
A.若反应2AB(g)C(g)+3D(g)在高温下能自发进行,其逆反应在低温下能自发进行,则该正反应的H<0、S>0
B.在101KPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)=2H2O(l) H=-571.6kJ/mol
C.一定条件下,反应2SO2(g)+O2(g)=2SO3(g)H<0达到平衡后,升高体系温度反应重新达到平衡前,有2v正(O2)>v逆(SO3)
D.酸与碱恰好完全反应生成正盐的c(H+)=c(OH-)=10-6mol/L的溶液一定呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.
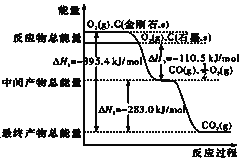
a.在通常状况下,金刚石和石墨相比较_____,(填”金刚石”或”石墨”)更稳定,石墨的燃烧热为_____.
b.12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为_____.
(2)已知:N2、O2分子中化学键的键能分别是946kJmol﹣1、497kJmol﹣1.N2(g)+O2(g)═2NO(g)△H=+180.0kJ·mol﹣1.NO分子中化学键的键能为_____kJ·mol﹣1.
(3)综合上述有关信息,请写出用CO除去NO的热化学方程式:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜溶液中滴入乙二胺(H2N—CH2—CH2—NH2)即可形成配离子A,其结构如图:

(1)基态的Cu2+核外电子排布式为________。
(2)元素C、N、O的第一电离能由大到小排列顺序为_______;![]() 的空间构型为________。
的空间构型为________。
(3)A中所形成的配离子中含有的化学键类型有__________(填标号)。
a.配位键 b.极性键 c.离子键 d.非极性键
(4)乙二胺分子中氮原子轨道的杂化类型为___________,乙二胺和三甲胺 [N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是________。
(5)硫酸铜灼烧可以生成一种红色晶体,其结构如图所示,则该化合物的化学式是____。已知晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,求晶胞边长a=______cm。(用含ρ、NA的计算式表示)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com