
����Ŀ��Ϊ�˼������ˮ��IJ���������ʵ�鷽����
![]()
��ش��������⣺
(1)�Լ�1Ϊ20%��H2SO4��Һ����������_________��
(2)�Լ�2Ϊ_________NaOH��Һ����������_________��ʹ����ˮ������ʵ�����˳�����У�������Ӧ�����ӷ���ʽΪ��_________��
(3)��Ӧ�ٵĻ�ѧ����ʽΪ_________��
(4)Ϊ�������Һ�Ƿ�����ȫˮ�⣬ȡ����ˮ��Һ���Թ��У������ˮ����֤������δ��ȫˮ���������_________��
(5)���ʵ�������û�м����Լ�2��ֱ�Ӽ����Լ�3���ܷ�ʵ��ʵ��Ŀ��_________����ܡ����������ܣ���ԭ����_________�������ܽ�Cu��OH��2��ʹʵ��ʧ�ܣ���ĸ�����ʩ��_________��
���𰸡������� ����������Һ�к������������� H++OH��=H2O ��C6H10O5��n+nH2O![]() nC6H12O6 ���ۡ������� ����ɫ �� �������ܽ�Cu��OH��2��ʹʵ��ʧ�� ֱ������Һ�м����Թ�����NaOH��Һ
nC6H12O6 ���ۡ������� ����ɫ �� �������ܽ�Cu��OH��2��ʹʵ��ʧ�� ֱ������Һ�м����Թ�����NaOH��Һ
��������
��1��ϡ�����ڵ��۵�ˮ����������������ӿ��˵��۵�ˮ�����ʣ�
��2������������ͭ��ȩ�ķ�Ӧ��Ҫ�ڼ��������·�Ӧ���У������кͷ�Ӧ��ʵ��д����Ӧ�����ӷ���ʽ��
��3����Ӧ��Ϊ���۵�ˮ�ⷴӦ����Ӧ���������ǣ�
��4�����������ۺ���ʾ��ɫ����֤������û����ȫˮ�⣻
��5������������ͭ�ܹ���ϡ���ᷴӦ����ʵ��ʧ�ܽ��з�������������Һ�м�������������Һ�к�ʣ������ᡣ
��1�����۵�ˮ����̣��������ϡ�������������ӿ���۵�ˮ�ⷴӦ���ʣ��ʴ�Ϊ����������
��2��ϡ�����ܹ���������ͭ��Ӧ���ᵼ��ʵ��ʧ�ܣ�����Ӧ���ȼ�������������Һ�к�ϡ���ᣬ���ӷ���ʽΪ��H++OH-=H2O���ʴ�Ϊ������������Һ���к������������H++OH-=H2O��
��3��������ϡ������������ȫˮ�����������ǣ�ˮ�ⷽ��ʽΪ��![]() ��
��
��4���������ⵥ������ɫ���ݴ˿��Լ�������Ƿ���ȫˮ�⣬����Ϊ��ȡ����ˮ��Һ���Թ��У������ˮ�������Һ����ɫ����֤������δ��ȫˮ�⣬�ʴ�Ϊ������ɫ��
��5��������������������кʹ���ϡ���ᣬ�����������ܽ�Cu(OH)2��ʹʵ��ʧ�ܣ����ﵽʵ��Ŀ�ģ�Ϊ�˱���ʵ��ʧ�ܣ�Ӧ��ֱ������Һ�м����Թ�����NaOH��Һ�к�ϡ���ᣬ�ʴ�Ϊ�����������ܽ�Cu(OH)2��ʹʵ��ʧ�ܣ�ֱ������Һ�м����Թ�����NaOH��Һ��


 ����ѧ���ʱѧ����ϵ�д�
����ѧ���ʱѧ����ϵ�д� �ʰ�Ӣ��ͬ����ϰ��ϵ�д�
�ʰ�Ӣ��ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ȼ�ѧ����ʽ�ó��Ľ�����ȷ���ǣ�������
A. ��֪2H2(g)+O2(g)��2H2O��l����H����483.6 kJmol��1����������ȼ����Ϊ483.6 kJmol��1
B. ��һ���¶Ⱥ�ѹǿ�£���0.5mol N2��1.5 mol H2�����ܱ������г�ַ�Ӧ����NH3(g)���ų�����19.3 kJ�������Ȼ�ѧ����ʽΪN2(g)+3H2(g)![]() 2NH3(g) ��H=��19.3kJ/mol
2NH3(g) ��H=��19.3kJ/mol
C. ��֪2C(s)+2O2(g)��2CO2(g)��H1��2C(s)+O2(g)��2CO(g)��H2������H1����H2
D. ��֪Ni(CO)4(s)��Ni(s)+4CO��g�� ��H��Q kJmol��1����Ni(s)+4CO��g����Ni(CO)4(s) ��H����Q kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����ʯ��ʯī��Ϊ̼��ͬ�������壬��������������ʱȼ������һ����̼������������ʱ���ȼ�����ɶ�����̼����Ӧ�зų���������ͼ��ʾ��
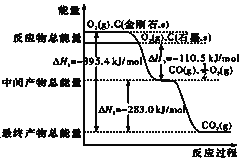
a.��ͨ��״���£����ʯ��ʯī��Ƚ�_____�����������ʯ������ʯī�������ȶ���ʯī��ȼ����Ϊ_____��
b.12gʯī��һ����������ȼ�գ���������36g���ù��̷ų�������Ϊ_____��
��2����֪��N2��O2�����л�ѧ���ļ��ֱܷ���946kJmol��1��497kJmol��1��N2��g��+O2��g���T2NO��g����H��+180.0kJ��mol��1��NO�����л�ѧ���ļ���Ϊ_____kJ��mol��1��
��3���ۺ������й���Ϣ����д����CO��ȥNO���Ȼ�ѧ����ʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ᣨ��ͼ����������������ҩ����Ұ���ܲ�����Ҷˮ�ա�������У���������ֹ Ѫ���ã����й��ڿ������˵������ȷ���ǣ� ��

A. ������ķ���ʽΪC9H8O4
B. 1mol��������Ժͺ�4molBr2��Ũ��ˮ��Ӧ
C. 1mol��������Ժ�3molNaOH��Ӧ
D. �����ø�����ؼ��������������к���̼̼˫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���л��������ư���ƥ�����е��廷(��ͼ)����ѧ�ҳ���Ϊ����ƥ�����������йذ���ƥ������˵����ȷ����
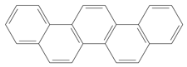
A.������һ�ȴ���ֻ��һ��
B.����������ֻ���Ǽ��Լ�
C.������ȫȼ������H2O�����ʵ���С��CO2�����ʵ���
D.�������ڱ���ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2A��g����B(g)![]() 3C(g)��4D(g)��Ӧ�У���ʾ�÷�Ӧ���������ǣ� ��
3C(g)��4D(g)��Ӧ�У���ʾ�÷�Ӧ���������ǣ� ��
A.����A���� 0.5 mol/��L����B.����D���� 1 mol/��L����
C.����C���� 0.8 mol/��L����D.����B���� 0.3 mol/��L����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ��Һ�е����Ҷ���(H2N��CH2��CH2��NH2)�����γ�������A����ṹ��ͼ��

(1)��̬��Cu2+��������Ų�ʽΪ________��
(2)Ԫ��C��N��O�ĵ�һ�������ɴ�С����˳��Ϊ_______��![]() �Ŀռ乹��Ϊ________��
�Ŀռ乹��Ϊ________��
(3)A�����γɵ��������к��еĻ�ѧ��������__________(����)��
a.��λ�� b.���Լ� c.���Ӽ� d.�Ǽ��Լ�
(4)�Ҷ��������е�ԭ�ӹ�����ӻ�����Ϊ___________���Ҷ��������װ� [N(CH3)3]�����ڰ������Ҷ��������װ��ķе�ߵĶ࣬ԭ����________��
(5)����ͭ���տ�������һ�ֺ�ɫ���壬��ṹ��ͼ��ʾ����û�����Ļ�ѧʽ��____����֪������ܶ�Ϊ��g��cm-3�������ӵ�����ΪNA�����߳�a=______cm��(�ú�����NA�ļ���ʽ��ʾ)

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������д����Ӧ���Ȼ�ѧ����ʽ��
(1)��֪16 g��������ȫȼ��ʱ�ų�148.4 kJ���������÷�Ӧȼ�յ��Ȼ�ѧ����ʽ��
____________________________________________________
(2)��ͼ��298 KʱN2��H2��Ӧ�����������仯������ͼ���÷�Ӧ���Ȼ�ѧ����ʽΪ��_________________________________��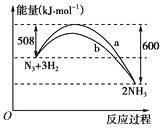
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᾧ�����ɿ���H2C2O4��xH2O��ʾ��Ϊ�˲ⶨxֵ����������ʵ�飺
�ٳ�ȡw g���ᾧ�壬���100.00 mLˮ��Һ��
����ȡ25.00 mL�����ƵIJ�����Һ������ƿ�ڣ���������ϡ���ᡣ
����Ũ��Ϊa mol��L-1��KMnO4��Һ�ζ���KMnO4������ɫΪֹ��
�������ķ�Ӧ��2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2��+2MnSO4+8H2O��
�Իش��������⣺
��1�����������У�ʵ���в���Ҫ����(�����)__________����ȱ�ٵ�������(������)_______________��
a.������ƽ(�����룬����)��b.�ζ���c.100 mL��Ͳ��d.100 mL����ƿ��e.�ձ���f.©��g.��ƿ��h.��������i.ҩ�ס� j.��ƿ
��2��ʵ���У���KMnO4��ҺӦװ��________ʽ�ζ����У���Ϊ_____________________��
��3�����ڽӽ��ζ��յ�ʱ������������ˮ����ƿ�ڱڳ�ϴһ�£��ټ����ζ����յ㣬������õ�xֵ��____(����ƫ��������ƫС��������Ӱ����)��
��4���ڵζ�����������a mol��L-1��KMnO4��ҺV mL���������ƵIJ�����Һ�����ʵ���Ũ��Ϊ___mol��L-1���ɴ˿ɼ���xֵ��____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com