
【题目】草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
①称取w g草酸晶体,配成100.00 mL水溶液。
②量取25.00 mL所配制的草酸溶液置于锥形瓶内,加入适量稀硫酸。
③用浓度为a mol·L-1的KMnO4溶液滴定至KMnO4不再褪色为止。
所发生的反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。
试回答下列问题:
(1)下列仪器中,实验中不需要的有(填序号)__________,还缺少的仪器有(填名称)_______________。
a.托盘天平(带砝码,镊子) b.滴定管c.100 mL量筒 d.100 mL容量瓶 e.烧杯 f.漏斗g.锥形瓶 h.玻璃棒 i.药匙 j.烧瓶
(2)实验中,标准KMnO4溶液应装在________式滴定管中,因为_____________________。
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值会____(填“偏大”、“偏小”或“无影响”)。
(4)在滴定过程中若用a mol·L-1的KMnO4溶液V mL,则所配制的草酸溶液的物质的量浓度为___mol·L-1,由此可计算x值是____。
【答案】cfi 铁架台(带滴定管夹)和胶头滴管 酸 KMnO4溶液具有强氧化性,能腐蚀橡胶管 无影响 0.1aV ![]() -5
-5
【解析】
(1)为了准确配制一定浓度的草酸溶液,所需要的实验仪器主要为:天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒、量筒等;用高锰酸钾溶液进行滴定测草酸的物质的量,所需要的实验仪器主要有:烧杯、酸式滴定管、铁架台(带滴定管夹)、锥形瓶等,则在以上操作中不需要的仪器有:c.100 mL量筒、f.漏斗、j.烧瓶;还缺少的仪器为:铁架台(带滴定管夹)和胶头滴管,故答案为cfj;铁架台(带滴定管夹)和胶头滴管;
(2)KMnO4溶液具有强氧化性,可以腐蚀碱式滴定管中的橡皮管,故KMnO4溶液应装在酸式滴定管中,故答案为酸;KMnO4溶液有强氧化性,能腐蚀碱式滴定管中的橡皮管;
(3)在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,蒸馏水不影待测液的物质的量,对V(标准)无影响,根据c(待测)=![]() 可知,c(待测)不变,则对所测得的x值无影响,故答案为无影响;
可知,c(待测)不变,则对所测得的x值无影响,故答案为无影响;
(4)2KMnO4 ~5H2C2O4
2 5
aV×10-3mol 0.025×cmol
c=![]() =0.1aVmolL-1,样品中含有草酸的质量为:90g/mol×0.1aVmol/L×0.025L×4=0.9aVg,Wg草酸晶体中含有结晶水的质量为Wg-0.9aVg,草酸晶体中含有结晶水数目为:x=
=0.1aVmolL-1,样品中含有草酸的质量为:90g/mol×0.1aVmol/L×0.025L×4=0.9aVg,Wg草酸晶体中含有结晶水的质量为Wg-0.9aVg,草酸晶体中含有结晶水数目为:x=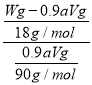 =
=![]() -5,故答案为0.1aV;
-5,故答案为0.1aV;![]() -5。
-5。


科目:高中化学 来源: 题型:
【题目】为了检验淀粉水解的产物,设计如下实验方案:
![]()
请回答下列问题:
(1)试剂1为20%的H2SO4溶液,其作用是_________;
(2)试剂2为_________NaOH溶液,其作用是_________,使检验水解产物的实验得以顺利进行;发生反应的离子方程式为:_________;
(3)反应①的化学方程式为_________;
(4)为检验淀粉液是否已完全水解,取少量水解液于试管中,加入碘水,则证明淀粉未完全水解的现象是_________;
(5)如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的_________(填”能”或”否”)否,若不能,其原因是_________硫酸能溶解Cu(OH)2而使实验失败,最简单的改正措施是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是

A.图甲表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
B.图乙是金刚石与石墨分别氧化生成CO2的能量关系曲线,说明石墨转化为金刚石的反应的ΔH>0
C.图丙表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点
D.图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予美国固体物理学家约翰·巴尼斯特·古迪纳(JohnB.Goodenough)、英国化学家斯坦利·威廷汉(StanleyWhittingham)和日本化学家吉野彰(AkiraYoshino),以表彰他们发明锂离子电池方面做出的贡献。全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )
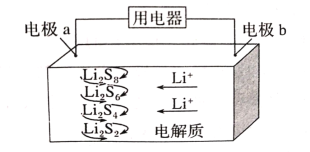
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B.电池工作时,外电路中流过0.02mol电子,负极材料减重0.14g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0 L真空密闭容器中充入4.0 mol A(g)和4.0 mol B(g),在一定温度下进行反应:A(g)+B(g)![]() C(g) ΔH,测得不同时刻该容器内物质的物质的量如下表:
C(g) ΔH,测得不同时刻该容器内物质的物质的量如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(A)/mol | 4.0 | 2.5 | 1.5 | n2 | n3 |
n(C)/mol | 0 | 1.5 | n1 | 3 | 3 |
回答下列问题:
(1)随着温度的升高,该反应的化学平衡常数减小,则ΔH__________(填“>”“<”或“=”)0,反应从起始到20 min内C的平均反应速率是________。
(2)该温度下,上述反应的化学平衡常数为________。平衡时体系内气体的总压强是反应起始时总压强的________。
(3)下列选项中能说明该反应在一定温度和恒容条件下达到平衡状态的是________。
A.反应速率:vA(正)+vB(正)=vC(逆)
B.A的质量不再改变
C.B的转化率不再改变
D.密度不再改变
(4)若反应C(g)![]() A(g)+B(g) ΔH>0,进行时需加入稀释剂X气体(不参与反应),则C的平衡转化率与体系的温度、压强、X的物质的量的关系如图1、图2所示。
A(g)+B(g) ΔH>0,进行时需加入稀释剂X气体(不参与反应),则C的平衡转化率与体系的温度、压强、X的物质的量的关系如图1、图2所示。


①由图1可知,T1________(填“>”“<”或“=”)T2。
②由图2可知,当其他条件不变时,增大X的物质的量,C的平衡转化率将________(填“增大”“减小”或“不变”),其原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种重要的化工原料,一种利用低品位铜矿![]() 主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等
主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等![]() 为原料制取CuCl的工艺流程如下:
为原料制取CuCl的工艺流程如下:
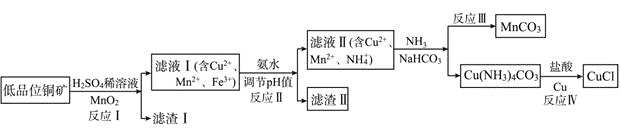
(1)反应Ⅰ“浸取”前需将铜矿粉碎的目的是___________________________;
(2)滤渣Ⅰ的成分除S和![]() 外还含有___________,反应 Ⅰ中
外还含有___________,反应 Ⅰ中![]() 的作用为_______________
的作用为_______________
(3)已知生成氢氧化物的pH如下表,则反应Ⅱ“中和”时,用氨水调pH的范围是______________。
物质 |
|
|
|
开始沉淀pH |
|
|
|
完全沉淀pH |
|
|
|
(4)检验滤液Ⅱ中是否含有![]() 所需要的试剂是:______________
所需要的试剂是:______________
(5)①反应Ⅲ中生成难溶![]() 的离子方程式:______________
的离子方程式:______________
②反应Ⅳ所对应的化学方程式:______________________________
(6) CuCl的定量分析
步骤1.取样品0.7500g和30.0mL 1.0mol·L-1过量的FeCl3溶液置于250mL的锥形瓶中,不断摇动。
步骤2.待样品溶解后,平均分为3份,用0.1000mol·L-1 Ce(SO4)2标准溶液进行滴定。
三次实验测得数据如下表
序号 | 1 | 2 | 3 |
起始读数 |
|
|
|
终点读数 |
|
|
|
已知:![]() ;
;![]() 。
。
①数据处理:计算得CuCl的纯度为_________![]()
②误差下列操作会使测定结果偏高的是______________
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线
C.0.1000mol·L-1硫酸铈溶液久置后浓度变小
D.滴定前滴定管尖嘴无气泡,滴定后产生气泡
E.用量筒取10.0mL 1.0mol·L-1的![]() 溶液时仰视刻度线
溶液时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体的叙述中,错误的是
A.氯化钠晶体中,每个Na+周围距离相等且最近的Na+共有6个
B.金属晶体中,以“…ABCABCABC…”形式的堆积称为面心立方堆积
C.干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子共有12个
D.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是( )
A. 用湿润的pH试纸测稀碱液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D. 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校兴趣小组的同学围绕Fe3+和S2-的反应,产生了激烈的争辩,请你帮助他们完成相应的记录
(1)甲同学认为,类似于Fe3+和I-,Fe3+和S2-也能发生氧化还原反应。其中,甲同学提到的Fe3+和I-发生反应的离子方程式是______。
(2)乙同学认为甲同学考虑欠周,他认为Fe3+和S2-发生反应的离子方程式可能跟滴加顺序有关。如果是向氯化铁溶液中逐滴加入硫化钠溶液,离子方程式类似于(1)中的离子方程式;如果是向硫化钠溶液中逐滴加入氯化铁溶液,离子方程式则有所不同,应该为______。
(3)丙同学的看法与甲,乙两位同学都不同,既然类比,他更倾向于与![]() 和
和![]() 的反应类比。这样说来,丙同学预期的Fe3+和S2-发生反应的离子方程式应为______。
的反应类比。这样说来,丙同学预期的Fe3+和S2-发生反应的离子方程式应为______。
(4)丁、戊和己三位同学急了,相约来到了实验室。其中丁同学是这样做的实验:称取______gFeCl3固体置于烧杯中,用______溶解,再加适量水配成100 mL溶液备用。取2 mL1 mol/L的FeCl3溶液于试管中,逐滴滴加0.1 mol/L的Na2S溶液。开始局部产生少量的黑色沉淀,振荡,黑色沉淀立即消失(若不振荡,黑色沉淀慢慢消失),同时溶液呈浅黄色浑浊,且有少量的红褐色絮状沉淀产生,闻到轻微的臭鸡蛋气味;滴加到5滴Na2S溶液时,溶液开始出现少量的蓝黑色沉淀,振荡,沉淀不消失;继续滴加Na2S溶液,产生大量沉淀。戊同学所做的实验跟丁同学所做的实验只在滴加顺序上存在不同,刚好形成补充。简述戊同学的实验操作______。
(5)已同学将戊同学在实验过程中得到的黑色沉淀A,连同实验室现有的FeS药品(分析纯)一起,做了三个小实验。
实验内容 | 实验现象 |
①A+H2O | 无明显现象,即便加热至沸腾,沉淀也不溶解,溶液颜色也不改变,更没有臭鸡蛋气味的气体生成 |
②A+HCl | 黑色沉淀溶解,并出现大量浅黄色沉淀,伴随有臭鸡蛋气味的气体生成 |
③FeS+HCl | 生成大量臭鸡蛋气味的气体,但没有浅黄色沉淀生成 |
根据已同学的实验可知,黑色沉淀A可能为______![]() 填化学式
填化学式![]() ;它在中性或碱性溶液中能稳定存在。据此可知向硫化钠溶液中加入少量氯化铁溶液的离子方程式可能为______。
;它在中性或碱性溶液中能稳定存在。据此可知向硫化钠溶液中加入少量氯化铁溶液的离子方程式可能为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com