
【题目】下列有关晶体的叙述中,错误的是
A.氯化钠晶体中,每个Na+周围距离相等且最近的Na+共有6个
B.金属晶体中,以“…ABCABCABC…”形式的堆积称为面心立方堆积
C.干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子共有12个
D.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
科目:高中化学 来源: 题型:
【题目】硫酸铜溶液中滴入乙二胺(H2N—CH2—CH2—NH2)即可形成配离子A,其结构如图:

(1)基态的Cu2+核外电子排布式为________。
(2)元素C、N、O的第一电离能由大到小排列顺序为_______;![]() 的空间构型为________。
的空间构型为________。
(3)A中所形成的配离子中含有的化学键类型有__________(填标号)。
a.配位键 b.极性键 c.离子键 d.非极性键
(4)乙二胺分子中氮原子轨道的杂化类型为___________,乙二胺和三甲胺 [N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是________。
(5)硫酸铜灼烧可以生成一种红色晶体,其结构如图所示,则该化合物的化学式是____。已知晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,求晶胞边长a=______cm。(用含ρ、NA的计算式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D. 水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
①称取w g草酸晶体,配成100.00 mL水溶液。
②量取25.00 mL所配制的草酸溶液置于锥形瓶内,加入适量稀硫酸。
③用浓度为a mol·L-1的KMnO4溶液滴定至KMnO4不再褪色为止。
所发生的反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。
试回答下列问题:
(1)下列仪器中,实验中不需要的有(填序号)__________,还缺少的仪器有(填名称)_______________。
a.托盘天平(带砝码,镊子) b.滴定管c.100 mL量筒 d.100 mL容量瓶 e.烧杯 f.漏斗g.锥形瓶 h.玻璃棒 i.药匙 j.烧瓶
(2)实验中,标准KMnO4溶液应装在________式滴定管中,因为_____________________。
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值会____(填“偏大”、“偏小”或“无影响”)。
(4)在滴定过程中若用a mol·L-1的KMnO4溶液V mL,则所配制的草酸溶液的物质的量浓度为___mol·L-1,由此可计算x值是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛化合物常见价态有+2和+4。钛白粉(TiO2,两性氧化物)用途广泛。工业上由高钛渣(主要成分为Ti3O5,还含有TiO2、Fe2O3等)制取钛白粉的主要工艺过程如下:
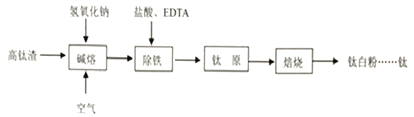
(1)写出碱熔步骤所发生反应的化学方程式____________、____________。
(2)实验测定EDTA加入量(EDTA和Fe3+的物质的量之比)对 Ti4+和Fe3+溶出率的影响如图所示。由图可知,EDTA的加入量为____________时除铁效率最佳,理由是____________。

(3)在实验室模拟除铁净化后的实验步骤:①向钛原料中加入稀硫酸生成偏钛酸(H2TiO3)沉淀,反应结束后过滤;②洗涤;③……;④在650℃下高温焙烧得到较纯的钛白粉固体。步骤③的实验目的是____________,需要用到的试剂有____________。
(4)测定钛白粉纯度:称取试样0.200g在CO2气氛下用金属铝将钛(IV)还原成钛(Ⅲ),还原后的溶液以NH4SCN为指示剂,用0.08mol/L的 NH4Fe(SO4)2标准液滴定,滴定终点时消耗标准液29.20mL,钛白粉的纯度为____________。(保留三位有效数字)
(5)最新研究发现也可以用图示装置由TiO2获得金属钛。装置中阳极的电极反应方程式为____________,在制备金属钛前后,整套装置中CaO的总量____________(填写“增大”、“减小”或者“不变”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
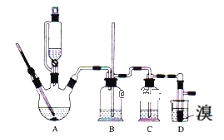
【题目】已知:实验室用少量的溴和足量的乙醇、浓硫酸制备1,2﹣二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)用少量的溴和足量的乙醇、浓硫酸制备1,2﹣二溴乙烷的需分两步进行,第一步需要在冰水浴下混合浓硫酸和乙醇,混合时加入试剂的顺序是___,使用冰水浴降温的目的是___,第二步反应的化学方程式___。
(2)在此实验中,要在A中加入___,防止___,反应温度提高到170℃左右,其最主要目的是___(填正确选项前的字母)。
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)装置B的作用是___,在装置C中应加入__,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母)。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断D中反应结束的方法是___,将D中1,2﹣二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层(填“上”、“下”)。
(5)若产物中有少量副产物乙醚,可用___的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离有机混合物的方法
B.在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度
C.实验室用已知浓度的醋酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞做指示剂比用甲基橙做指示剂时带来的误差要小一些
D.溶液配制、中和滴定实验中,容量瓶、锥形瓶用蒸馏水洗净后即可使用;而滴定管、移液管用蒸馏水洗净后,须再用待盛液润洗2~3次后方可使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.向AlCl3溶液中滴加足量氨水:Al3++3NH3·H2O![]() Al(OH)3↓+3NH4+
Al(OH)3↓+3NH4+
B.向碳酸氢钠溶液滴加澄清石灰水:HCO3-+OH-=H2O+CO32-
C.向大理石上滴加醋酸:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
D.用稀硝酸洗涤试管内壁银镜:Ag+2H++NO3-=Ag++NO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 常温下,向20 mL 0.01mol/L CH3COOH溶液中逐滴加入0.01mol/L 的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是

A.从a到c,醋酸的电离始终受到促进
B.a、d对应的纵坐标数值分别是:>10-12、>10-7
C.b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D.从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com