
【题目】下列指定反应的离子方程式正确的是
A.向AlCl3溶液中滴加足量氨水:Al3++3NH3·H2O![]() Al(OH)3↓+3NH4+
Al(OH)3↓+3NH4+
B.向碳酸氢钠溶液滴加澄清石灰水:HCO3-+OH-=H2O+CO32-
C.向大理石上滴加醋酸:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
D.用稀硝酸洗涤试管内壁银镜:Ag+2H++NO3-=Ag++NO2↑+H2O
【答案】A
【解析】
A. Al(OH)3只能溶于强碱,不能溶于弱碱,因此向AlCl3溶液中滴加足量氨水,只能生成Al(OH)3,离子方程式为:Al3++3NH3·H2O![]() Al(OH)3↓+3NH4+,A项正确;
Al(OH)3↓+3NH4+,A项正确;
B. 向碳酸氢钠溶液滴加少量澄清石灰水,离子方程式为:HCO3-+Ca2++OH-=H2O+Ca CO3↓,当滴加过量的澄清石灰水时,离子方程式为:2HCO3-+Ca2++2OH-=2H2O+CO32-+ CaCO3↓,B项错误;
C. 碳酸钙与醋酸反应生成醋酸钙和水,离子方程式为:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O,C项错误;
D. 用稀硝酸洗涤试管内壁银镜,离子方程式为:3Ag+4H++NO3-=3Ag++NO2↑+2H2O,D项错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是

A.图甲表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
B.图乙是金刚石与石墨分别氧化生成CO2的能量关系曲线,说明石墨转化为金刚石的反应的ΔH>0
C.图丙表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点
D.图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体的叙述中,错误的是
A.氯化钠晶体中,每个Na+周围距离相等且最近的Na+共有6个
B.金属晶体中,以“…ABCABCABC…”形式的堆积称为面心立方堆积
C.干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子共有12个
D.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是( )
A. 用湿润的pH试纸测稀碱液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D. 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL 1.0 mol·L-1盐酸溶液和V2mL未知浓度的氢氧化钠溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
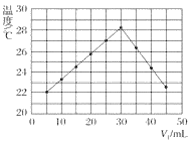
下列叙述正确的是( )
A.做该实验时环境温度为20 ℃
B.该实验表明化学能可能转化为热能
C.氢氧化钠溶液的浓度约为1.0 mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各实验装置图的叙述中,正确的是( )
A.装置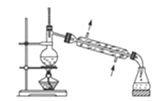 常用于分离互不相溶的液体混合物
常用于分离互不相溶的液体混合物
B.装置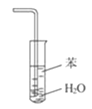 可用于吸收NH3,并防止倒吸
可用于吸收NH3,并防止倒吸
C.图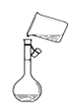 是将溶解好的溶液转移到容量瓶中
是将溶解好的溶液转移到容量瓶中
D.图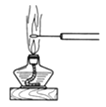 可观察NaCl的焰色反应
可观察NaCl的焰色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时:
①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH1=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)=H2O(l) ΔH2=-57.3 kJ·mol-1
③Ba2+(aq)+SO42—(aq)=BaSO4(s) ΔH3<0
下列说法正确的是( )
A.HF的电离方程式及热效应:HF(aq)=H+(aq)+F-(aq) ΔH>0
B.在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大
C.ΔH2=-57.3 kJ·mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热
D.稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)ΔH=-114.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校兴趣小组的同学围绕Fe3+和S2-的反应,产生了激烈的争辩,请你帮助他们完成相应的记录
(1)甲同学认为,类似于Fe3+和I-,Fe3+和S2-也能发生氧化还原反应。其中,甲同学提到的Fe3+和I-发生反应的离子方程式是______。
(2)乙同学认为甲同学考虑欠周,他认为Fe3+和S2-发生反应的离子方程式可能跟滴加顺序有关。如果是向氯化铁溶液中逐滴加入硫化钠溶液,离子方程式类似于(1)中的离子方程式;如果是向硫化钠溶液中逐滴加入氯化铁溶液,离子方程式则有所不同,应该为______。
(3)丙同学的看法与甲,乙两位同学都不同,既然类比,他更倾向于与![]() 和
和![]() 的反应类比。这样说来,丙同学预期的Fe3+和S2-发生反应的离子方程式应为______。
的反应类比。这样说来,丙同学预期的Fe3+和S2-发生反应的离子方程式应为______。
(4)丁、戊和己三位同学急了,相约来到了实验室。其中丁同学是这样做的实验:称取______gFeCl3固体置于烧杯中,用______溶解,再加适量水配成100 mL溶液备用。取2 mL1 mol/L的FeCl3溶液于试管中,逐滴滴加0.1 mol/L的Na2S溶液。开始局部产生少量的黑色沉淀,振荡,黑色沉淀立即消失(若不振荡,黑色沉淀慢慢消失),同时溶液呈浅黄色浑浊,且有少量的红褐色絮状沉淀产生,闻到轻微的臭鸡蛋气味;滴加到5滴Na2S溶液时,溶液开始出现少量的蓝黑色沉淀,振荡,沉淀不消失;继续滴加Na2S溶液,产生大量沉淀。戊同学所做的实验跟丁同学所做的实验只在滴加顺序上存在不同,刚好形成补充。简述戊同学的实验操作______。
(5)已同学将戊同学在实验过程中得到的黑色沉淀A,连同实验室现有的FeS药品(分析纯)一起,做了三个小实验。
实验内容 | 实验现象 |
①A+H2O | 无明显现象,即便加热至沸腾,沉淀也不溶解,溶液颜色也不改变,更没有臭鸡蛋气味的气体生成 |
②A+HCl | 黑色沉淀溶解,并出现大量浅黄色沉淀,伴随有臭鸡蛋气味的气体生成 |
③FeS+HCl | 生成大量臭鸡蛋气味的气体,但没有浅黄色沉淀生成 |
根据已同学的实验可知,黑色沉淀A可能为______![]() 填化学式
填化学式![]() ;它在中性或碱性溶液中能稳定存在。据此可知向硫化钠溶液中加入少量氯化铁溶液的离子方程式可能为______。
;它在中性或碱性溶液中能稳定存在。据此可知向硫化钠溶液中加入少量氯化铁溶液的离子方程式可能为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿水青山就是金山銀山,生产生活中污染物的合理处理对环境保护具有重要意义。
(1)利用某些催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。
已知:①![]()
![]()
②NO(g)+CO(g)![]()
![]() N2(g)+CO2(g)
N2(g)+CO2(g)![]()
③2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g) ![]()
反应![]() 的
的![]() ________
________![]() ;某温度下,反应①②③的平衡常数分別カ
;某温度下,反应①②③的平衡常数分別カ![]() 、
、![]() 、
、![]() ,则该反应的K=________(用
,则该反应的K=________(用![]() 、
、![]() 、
、![]() 表示)。
表示)。
(2)温度为![]() ℃吋,在四个容积均为1L的恒容密闭容器中发生反应:
℃吋,在四个容积均为1L的恒容密闭容器中发生反应:
![]()
![]() ,测得有关实验数据如下:
,测得有关实验数据如下:
容器编号 | 物质的起始浓度( | 物质的平衡浓度( | |
|
|
| |
Ⅰ |
|
|
|
Ⅱ |
|
| |
Ⅲ |
|
| |
Ⅳ |
|
| |
①平衡时,容器Ⅱ与Ⅳ容器的总压强之比___________。
②温度不变,容器Ⅲ中达到平衡后再充入NO、![]() (g)各
(g)各![]() mol,则反应将向_____________。(填“正”或“逆”)方向进行。
mol,则反应将向_____________。(填“正”或“逆”)方向进行。
(3)常温下用0.100![]() 盐酸分别滴定10.00mL浓度均为0.100
盐酸分别滴定10.00mL浓度均为0.100![]() 的NaOH溶液和二甲胺[
的NaOH溶液和二甲胺[![]() ]
]

①a、b、c、d四点的水溶液中,由水电离出氢离子浓度大于![]()
![]() 的是________________,原因为_____________________。
的是________________,原因为_____________________。
②化学反应往往伴有热效应若为绝热体系a的温度______________(填“>”,“=”或“<”)c点的温度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com