
【题目】下列关于各实验装置图的叙述中,正确的是( )
A.装置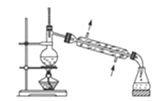 常用于分离互不相溶的液体混合物
常用于分离互不相溶的液体混合物
B.装置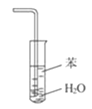 可用于吸收NH3,并防止倒吸
可用于吸收NH3,并防止倒吸
C.图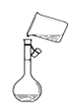 是将溶解好的溶液转移到容量瓶中
是将溶解好的溶液转移到容量瓶中
D.图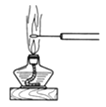 可观察NaCl的焰色反应
可观察NaCl的焰色反应
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)催化转化器可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5 kJ/mol;
2C(s)+O2(g)=2CO(g) △H2=-221.0 kJ/mol;
C(s)+O2(g)=CO2(g) △H3=-393.5 kJ/mol
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=___________。
(2)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
①该温度下,若向同容积的另一容器中投入N2、H2、NH3,其浓度均为3 mol/L,则此时v正____v逆(填“大于”“小于”或“等于”)。
②由表中的实验数据可得到“c—t”的关系,如图所示,表示c(N2)—t的曲线是______。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为________。

(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △H=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
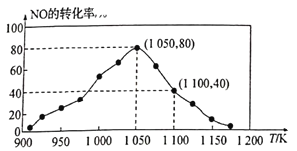
①由图可知,在1100K时,CO2的体积分数为__________。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=______[已知:气体分压(P分)=气体总压(Pa)×体积分数]。
(4)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯![]() 原理如图所示
原理如图所示
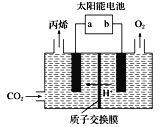
①太阳能电池的负极是_______(填“a”或“b”)
②生成丙烯的电极反应式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
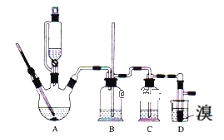
【题目】已知:实验室用少量的溴和足量的乙醇、浓硫酸制备1,2﹣二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)用少量的溴和足量的乙醇、浓硫酸制备1,2﹣二溴乙烷的需分两步进行,第一步需要在冰水浴下混合浓硫酸和乙醇,混合时加入试剂的顺序是___,使用冰水浴降温的目的是___,第二步反应的化学方程式___。
(2)在此实验中,要在A中加入___,防止___,反应温度提高到170℃左右,其最主要目的是___(填正确选项前的字母)。
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)装置B的作用是___,在装置C中应加入__,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母)。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断D中反应结束的方法是___,将D中1,2﹣二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层(填“上”、“下”)。
(5)若产物中有少量副产物乙醚,可用___的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A.已知C(石墨,s)![]() C(金刚石,s) △H=+1.9 kJ/mol,则金刚石比石墨稳定
C(金刚石,s) △H=+1.9 kJ/mol,则金刚石比石墨稳定
B.氢气的燃烧热为-285.5 kJ·mol-1,则水电解的热化学方程式为:2H2O(l)=2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H =-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g)放热19.3 kJ,热化学方程式为:N2(g)+3H2(g)=2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.向AlCl3溶液中滴加足量氨水:Al3++3NH3·H2O![]() Al(OH)3↓+3NH4+
Al(OH)3↓+3NH4+
B.向碳酸氢钠溶液滴加澄清石灰水:HCO3-+OH-=H2O+CO32-
C.向大理石上滴加醋酸:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
D.用稀硝酸洗涤试管内壁银镜:Ag+2H++NO3-=Ag++NO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”是建设美丽中国的发展方向。
(1) 已知:① CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.1kJ/mol
② 2H2(g)+CO(g)=CH3OH(l) ΔH2=-128.3kJ/mol
③ 2H2(g)+O2(g)=2H2O(g) ΔH3=-481.9kJ/mol
常温下,在合适催化剂的作用下,采用CH4和O2一步合成液态CH3OH的热化学方程式为____。
(2) 二甲醚(CH3OCH3)是清洁能源。利用合成气合成二甲醚的原理是2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) ΔH<0。在一定条件下,在反应中CO的平衡转化率α(CO)与温度(T)、投料比n(H2)/n(CO)的关系如图1所示,平衡常数K与温度(T)的关系如图2所示。
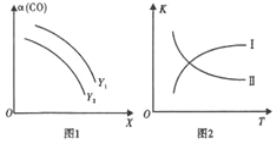
①图1中,X代表____;Y1____Y2 (填“>”“<”或“=”)。
②图2中,曲线____(填I或II)符合平衡常数变化规律。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电解饱和食盐水来制取烧碱,所用的食盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.用盐酸调节滤液的pH,获得一次精制盐水。
(1)过程Ⅰ中除去的离子是______。
(2)表是过程Ⅰ、Ⅱ中生成的部分沉淀及其在20℃时的溶解度(g/100 gH2O):
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 | 4.8×10-9 |
运用表中信息回答下列问题:
①过程Ⅱ中生成的主要沉淀除CaCO3和Mg2(OH)2CO3外还有______。
②过程Ⅰ选用的是BaCl2而不选用CaCl2,原因是______。
③除去Mg2+的离子方程式是______。
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是______。
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意图如图:
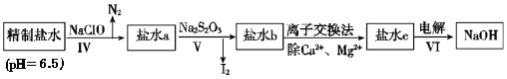
①过程Ⅳ除去的离子是______。
②盐水b中含有SO42-,Na2S2O3将IO3-还原为I2的离子方程式是______。
③在过程Ⅴ中所用的Na2S2O3俗称海波,是一种重要的化工原料。商品海波主要成分是Na2S2O3·5H2O为了测定其含Na2S2O3·5H2O的纯度,称取8.00 g样品,配制成250.0 mL溶液,取25.00 mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500 mol/L的碘水滴定(发生反应2S2O32-+I2=S4O62-+2I-),滴定达到终点时的现象是______。下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
第一次 | 0.30 | 31.12 |
第二次 | 0.36 | 31.56 |
第三次 | 1.10 | 31.88 |
计算样品的纯度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼(BCl3)是一种重要的化工原料。实验室制备BCl3的原理B2O3+3C+3Cl2![]() 2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。(已知:BCl3的熔点为-107.3℃,沸点为12.5℃;硝基苯的密度比水大)。请回答下列问题:
2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。(已知:BCl3的熔点为-107.3℃,沸点为12.5℃;硝基苯的密度比水大)。请回答下列问题:

实验Ⅰ:制备BCl3并验证产物CO
(1)该实验装置中合理的连接顺序为G→______→______→______→______→F→D→I;其中装置E的作用是______。
(2)BCl3接触潮湿空气时会形成白雾,请写出该反应的化学方程式______。
(3)能证明反应中有CO生成的现象是______。
实验Ⅱ:产品中氯含量的测定
①准确称取少许m g产品,置于蒸馏水中完全水解,并配成100 mL溶液。
②取10.00 mL溶液于锥形瓶中
③加入V1 mL浓度为c1mol/L AgNO3溶液使氯离子完全沉淀;向其中加入少许硝基苯用力摇动。
④以硝酸铁为指示剂,用c2 mol/LKSCN标准溶液滴定过量的AgNO3溶液。重复步骤②~④二次,达到滴定终点时用去KSCN溶液的平均体积为V2 mL。
已知:Ksp(AgCl)>Ksp(AgSCN)。
(4)步骤②移取溶液时所需仪器名称为______,步骤④中达到滴定终点的现象为______。
(5)产品中氯元素的质量分数为______。
(6)下列操作,可能引起测得产品中氯含量偏高是______。
A.步骤③中未加硝基苯
B.步骤①中配制100 mL溶液时,定容时俯视刻度线
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡
D.滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型漂白剂(如下图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是

A.工业上通过电解熔融的WX来制得W
B.W、X对应的简单离子半径顺序为:W>X
C.Y的最高价氧化物对应水化物为弱酸
D.该漂白剂中各元素均满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com