
【题目】“低碳经济”是建设美丽中国的发展方向。
(1) 已知:① CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.1kJ/mol
② 2H2(g)+CO(g)=CH3OH(l) ΔH2=-128.3kJ/mol
③ 2H2(g)+O2(g)=2H2O(g) ΔH3=-481.9kJ/mol
常温下,在合适催化剂的作用下,采用CH4和O2一步合成液态CH3OH的热化学方程式为____。
(2) 二甲醚(CH3OCH3)是清洁能源。利用合成气合成二甲醚的原理是2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) ΔH<0。在一定条件下,在反应中CO的平衡转化率α(CO)与温度(T)、投料比n(H2)/n(CO)的关系如图1所示,平衡常数K与温度(T)的关系如图2所示。
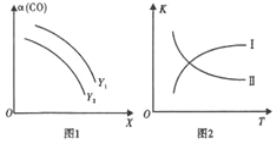
①图1中,X代表____;Y1____Y2 (填“>”“<”或“=”)。
②图2中,曲线____(填I或II)符合平衡常数变化规律。
【答案】2CH4(g)+O2(g)=2CH3OH(l) ΔH=-326.3kJ/mol 温度 > II
【解析】
(1)根据盖斯定律计算,(①+②)×2+③得到;
(2)①反应为气体体积减小的放热反应,X增大![]() 的平衡转化率
的平衡转化率![]() 减小,说明X增大平衡逆向进行,X为温度,温度一定,Y表示压强;
减小,说明X增大平衡逆向进行,X为温度,温度一定,Y表示压强;
②平衡常数随温度变化,该反应的正反应为放热反应,升温平衡逆向进行,平衡常数减小。
(1)根据盖斯定律计算,(①+②)×2+③得到:在合适催化剂的作用下,采用![]() 和
和![]() 一步合成液态
一步合成液态![]() 的热化学方程式为
的热化学方程式为![]() ,
,
故答案为:![]() ;
;
(2)①![]() ,反应为气体体积减小的放热反应,X增大
,反应为气体体积减小的放热反应,X增大![]() 的平衡转化率
的平衡转化率![]() 减小,说明X增大平衡逆向进行,X为温度,温度一定,Y表示压强,压强越大
减小,说明X增大平衡逆向进行,X为温度,温度一定,Y表示压强,压强越大![]() 转化率增大,
转化率增大,![]() ,
,
故答案为:温度;>;
②平衡常数随温度变化,该反应的正反应为放热反应,升温平衡逆向进行,平衡常数减小,则曲线Ⅱ符合平衡常数变化规律,
故答案为:Ⅱ。


科目:高中化学 来源: 题型:
【题目】一种化学名为 2,4,4—三氯—2— 羟基—二苯醚的物质(如下图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用。则下列有关说法中正确的是 ( )

A. 该物质与 FeCl3溶液混合后不显色
B. 该物质中所有原子一定处于同一平面
C. 该物质苯环上的一溴取代物有 6 种
D. 物质的分子式为 C12H6Cl3O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.4CuO(s)=2Cu2O(s)+O2(g)在室温下不能自发进行,说明该反应△H>0
B.向稀醋酸中加入醋酸钠固体,溶液pH升高的主要原因是醋酸钠水解呈碱性
C.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN大
D.H2S(g)+FeO(s)![]() FeS(s)+H2O(g),其他条件不变时增大压强,反应速率V正(H2S)和H2S的平衡转化率均增大
FeS(s)+H2O(g),其他条件不变时增大压强,反应速率V正(H2S)和H2S的平衡转化率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1的(NH4)2SO4溶液中:Na+、Cu2+、Cl-、OH-
B.![]() =10-12的溶液中:Na+、NO3-、AlO2-、CO32-
=10-12的溶液中:Na+、NO3-、AlO2-、CO32-
C.水电离的c(H+) =1×10-13mol·L-1溶液中:Na+、K+、NO3-、HCO3-
D.0.1 mol·L-1的FeCl3溶液中:K+、Mg2+、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各实验装置图的叙述中,正确的是( )
A.装置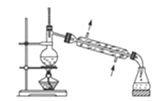 常用于分离互不相溶的液体混合物
常用于分离互不相溶的液体混合物
B.装置 可用于吸收NH3,并防止倒吸
可用于吸收NH3,并防止倒吸
C.图 是将溶解好的溶液转移到容量瓶中
是将溶解好的溶液转移到容量瓶中
D.图 可观察NaCl的焰色反应
可观察NaCl的焰色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZnNiOOH二次电池,结构如图所示。电池反应为Zn+2NiOOH+H2O ![]() ZnO+2Ni(OH)2。下列说法正确的是
ZnO+2Ni(OH)2。下列说法正确的是

A.放电时负极附近的pH升高
B.放电过程中OH-通过隔膜从负极区移向正极区
C.充电时3DZn电极应与外接直流电源的正极相连
D.充电时阳极反应为:Ni(OH)2+OH--e-=NiOOH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、50 mL 0.50mol/L盐酸、50 mL 0.55mol/LNaOH溶液,实验尚缺少的玻璃用品是____、____。
(2)NaOH稍过量的原因是_______。
(3)实验中若改用60 mL 0.50 mol/L盐酸和50 mL 0.55 mol/LNaOH溶液进行上述反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热____(填“相等”或“不相等”),理由是________。
(4)他们记录的实验数据如下:
实 验 用 品 | 溶液温度 | ||
t1 | t2 | ||
① | 50 mL 0.55mol/LNaOH溶液 | 20 ℃ | 23.3 ℃ |
50 mL 0.50mol/L盐酸 | |||
② | 50 mL 0.55mol/LNaOH溶液 | 20 ℃ | 23.5 ℃ |
50 mL 0.50mol/L盐酸 | |||
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 J/(℃g),各物质的密度均为1 g/cm3。根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:____。
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热(ΔH)______(填“偏大”“偏小”或“不变”),其原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂,实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图,主要步骤如下:

步骤1三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15mL液溴。
步骤2缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性;
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的作用是______,实验中不能用干燥空气代替干燥N2,原因是______。
(2)如将装置B改为装置C,可能会导致的后果是______。

(3)步骤3中,第一次过滤除去的物质是______。
(4)有关步骤4的说法,正确的是______。
A.可用95%的乙醇代替苯溶解粗品
B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯
D.该步骤的目的是除去乙醚和可能残留的溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿![]() 主要成分为
主要成分为![]() ,还有少量的
,还有少量的![]() 等杂质
等杂质![]() 提取氧化铝作冶炼铝的原料,提取的操作过程如下:
提取氧化铝作冶炼铝的原料,提取的操作过程如下:
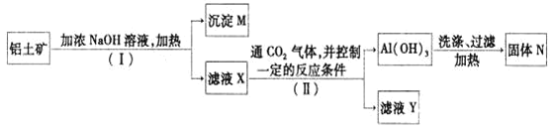
(1)![]() 和II步骤中分离溶液和沉淀的操作为_________,所用到的玻璃仪器是:________;
和II步骤中分离溶液和沉淀的操作为_________,所用到的玻璃仪器是:________;
(2)沉淀M中除含有泥沙外,一定还含有_______,固体N是_______;
(3)滤液X中,含铝元素的溶质的化学式为______,它属于_____![]() 填“酸”、“碱”或“盐”
填“酸”、“碱”或“盐”![]() 类物质;
类物质;
(4)实验室里常往![]() 溶液中加入___________
溶液中加入___________![]() 填“氨水”或“NaOH溶液”
填“氨水”或“NaOH溶液”![]() 来制取
来制取![]() ;
;
(5)将铝粉和氧化铁的混合物点燃,反应放出大量的热量,生成的液态的铁用来焊接铁轨。请写出反应的化学方程式:______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com