
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、50 mL 0.50mol/L盐酸、50 mL 0.55mol/LNaOH溶液,实验尚缺少的玻璃用品是____、____。
(2)NaOH稍过量的原因是_______。
(3)实验中若改用60 mL 0.50 mol/L盐酸和50 mL 0.55 mol/LNaOH溶液进行上述反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热____(填“相等”或“不相等”),理由是________。
(4)他们记录的实验数据如下:
实 验 用 品 | 溶液温度 | ||
t1 | t2 | ||
① | 50 mL 0.55mol/LNaOH溶液 | 20 ℃ | 23.3 ℃ |
50 mL 0.50mol/L盐酸 | |||
② | 50 mL 0.55mol/LNaOH溶液 | 20 ℃ | 23.5 ℃ |
50 mL 0.50mol/L盐酸 | |||
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 J/(℃g),各物质的密度均为1 g/cm3。根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:____。
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热(ΔH)______(填“偏大”“偏小”或“不变”),其原因是_______。
【答案】量筒 温度计 保证盐酸溶液完全反应 不相等 相等 中和热是指酸与碱发生中和反应生成1 mol液态H2O时所释放的热量,与酸、碱的用量无关,因此所求中和热相等 HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-56.85 kJ/mol 偏大 醋酸在溶液中电离吸收热量,使测得的中和热(ΔH)偏大
【解析】
(1)根据中和热测定的实验步骤选用需要的仪器,然后判断还缺少的仪器;
(2)NaOH的浓度比HCl的大,目的是NaOH过量,确保盐酸完全反应;
(3)物质反应放出的热量与反应的物质多少相对应。中和热是酸、碱发生中和反应产生1molH2O时放出的热量;
(4)先判断温度差的有效性,然后求出温度差的平均值,再根据Q=mc△T计算反应放出的热量,然后根据△H=-![]() kJ/mol计算出反应热;
kJ/mol计算出反应热;
(5)根据醋酸是弱酸,电离吸收热量分析。
(1)中和热的测定过程中,需要用量筒量取酸溶液、碱溶液的体积,需要使用温度计测量温度,所以还缺少量筒和温度计;
(2)NaOH与HCl的体积相同,而NaOH的浓度比HCl的大,目的是NaOH过量,确保盐酸完全反应,使反应更充分;
(3)化学反应过程中放出的热量与反应的物质多少有关,若实验中若改用60 mL 0.50 mol/L盐酸和50 mL 0.55 mol/LNaOH溶液进行上述反应,反应放出的热量以不足量的NaOH为标准,由于反应的NaOH增多,反应产生的H2O的物质的量也增多,所以反应放出的热量也比前者多,二者数值不相等,但由于中和热是酸、碱发生中和反应产生1molH2O时放出的热量,因此所求的中和热相等;
(4)两次温度差分别为:3.3℃,3.5℃,2组数据都有效,温度差平均值为3.4℃,50mL0.55mol/LNaOH和50mL0.5mol/LHCl反应产生水的物质的量以不足量的HCl为标准计算,n(H2O)=0.5mol/L×0.05L=0.025mol,混合溶液的质量和m(混合)=100mL×1g/mL=100g,c=4.18J/(g℃),△T=3.4℃,代入公式Q=cmc△T,可得生成0.025mol的水放出热量Q=4.18J/(g℃)×100g×3.4℃=1421.2J=1.4212kJ,即生成0.025mol的水放出热量1.4212kJ,所以生成1mol的水放出热量Q=![]() =56.85kJ,即该实验测得的中和热△H=-56.85kJ/mol。所以该反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-56.85 kJ/mol;
=56.85kJ,即该实验测得的中和热△H=-56.85kJ/mol。所以该反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-56.85 kJ/mol;
(5)若用醋酸代替HCl,由于醋酸为弱酸,电离过程需吸收热量,导致溶液的温度升高偏低,产生等量的水,反应放出的热量偏少,使测得的中和热(ΔH)偏大。


科目:高中化学 来源: 题型:
【题目】关于下列图像的叙述正确的是

A.图I表示:反应I2(g)+H2(g) ![]() 2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度
2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度
B.图Ⅱ表示:25℃时,用醋酸溶液滴定40.00 mL 0.1000 mol·L-1NaOH溶液的滴定曲线,其中c(CH3COOH)=0.1000mol/L
C.图Ⅲ表示:反应2NO2(g) ![]() N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2
N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2
D.图Ⅳ表示:25℃时,分别稀释等体积,等pH的NaOH溶液与氨水时的pH变化,其中曲线a对应氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A.已知C(石墨,s)![]() C(金刚石,s) △H=+1.9 kJ/mol,则金刚石比石墨稳定
C(金刚石,s) △H=+1.9 kJ/mol,则金刚石比石墨稳定
B.氢气的燃烧热为-285.5 kJ·mol-1,则水电解的热化学方程式为:2H2O(l)=2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H =-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g)放热19.3 kJ,热化学方程式为:N2(g)+3H2(g)=2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”是建设美丽中国的发展方向。
(1) 已知:① CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.1kJ/mol
② 2H2(g)+CO(g)=CH3OH(l) ΔH2=-128.3kJ/mol
③ 2H2(g)+O2(g)=2H2O(g) ΔH3=-481.9kJ/mol
常温下,在合适催化剂的作用下,采用CH4和O2一步合成液态CH3OH的热化学方程式为____。
(2) 二甲醚(CH3OCH3)是清洁能源。利用合成气合成二甲醚的原理是2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) ΔH<0。在一定条件下,在反应中CO的平衡转化率α(CO)与温度(T)、投料比n(H2)/n(CO)的关系如图1所示,平衡常数K与温度(T)的关系如图2所示。
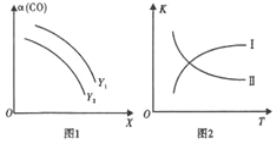
①图1中,X代表____;Y1____Y2 (填“>”“<”或“=”)。
②图2中,曲线____(填I或II)符合平衡常数变化规律。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电解饱和食盐水来制取烧碱,所用的食盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.用盐酸调节滤液的pH,获得一次精制盐水。
(1)过程Ⅰ中除去的离子是______。
(2)表是过程Ⅰ、Ⅱ中生成的部分沉淀及其在20℃时的溶解度(g/100 gH2O):
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 | 4.8×10-9 |
运用表中信息回答下列问题:
①过程Ⅱ中生成的主要沉淀除CaCO3和Mg2(OH)2CO3外还有______。
②过程Ⅰ选用的是BaCl2而不选用CaCl2,原因是______。
③除去Mg2+的离子方程式是______。
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是______。
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意图如图:
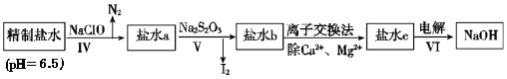
①过程Ⅳ除去的离子是______。
②盐水b中含有SO42-,Na2S2O3将IO3-还原为I2的离子方程式是______。
③在过程Ⅴ中所用的Na2S2O3俗称海波,是一种重要的化工原料。商品海波主要成分是Na2S2O3·5H2O为了测定其含Na2S2O3·5H2O的纯度,称取8.00 g样品,配制成250.0 mL溶液,取25.00 mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500 mol/L的碘水滴定(发生反应2S2O32-+I2=S4O62-+2I-),滴定达到终点时的现象是______。下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
第一次 | 0.30 | 31.12 |
第二次 | 0.36 | 31.56 |
第三次 | 1.10 | 31.88 |
计算样品的纯度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。
①仪器m的名称为___,装置F中试剂的作用是___。
②装置连接顺序:A→___→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和___。
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式___。
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案___(填“可行”或“不可行”),原因是___。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:

①W溶液可以是___(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为____(用含V、m的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼(BCl3)是一种重要的化工原料。实验室制备BCl3的原理B2O3+3C+3Cl2![]() 2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。(已知:BCl3的熔点为-107.3℃,沸点为12.5℃;硝基苯的密度比水大)。请回答下列问题:
2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。(已知:BCl3的熔点为-107.3℃,沸点为12.5℃;硝基苯的密度比水大)。请回答下列问题:

实验Ⅰ:制备BCl3并验证产物CO
(1)该实验装置中合理的连接顺序为G→______→______→______→______→F→D→I;其中装置E的作用是______。
(2)BCl3接触潮湿空气时会形成白雾,请写出该反应的化学方程式______。
(3)能证明反应中有CO生成的现象是______。
实验Ⅱ:产品中氯含量的测定
①准确称取少许m g产品,置于蒸馏水中完全水解,并配成100 mL溶液。
②取10.00 mL溶液于锥形瓶中
③加入V1 mL浓度为c1mol/L AgNO3溶液使氯离子完全沉淀;向其中加入少许硝基苯用力摇动。
④以硝酸铁为指示剂,用c2 mol/LKSCN标准溶液滴定过量的AgNO3溶液。重复步骤②~④二次,达到滴定终点时用去KSCN溶液的平均体积为V2 mL。
已知:Ksp(AgCl)>Ksp(AgSCN)。
(4)步骤②移取溶液时所需仪器名称为______,步骤④中达到滴定终点的现象为______。
(5)产品中氯元素的质量分数为______。
(6)下列操作,可能引起测得产品中氯含量偏高是______。
A.步骤③中未加硝基苯
B.步骤①中配制100 mL溶液时,定容时俯视刻度线
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡
D.滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示0.001 mol·L一1盐酸滴定0.001 mol·L一1NaOH溶液的滴定曲线
B.图2所示,石墨的熔点比金刚石低
C.图3表示的是Al3+与OH一反应时含铝微粒浓度变化曲线,图中a区域的物质是Al(OH)3
D.图4所示,图中的阴影部分面积的含义是「v(正)一v(逆)〕
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为:Cu + Br2=CuBr2。下列说法正确的是( )
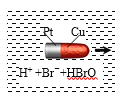
A.铜为电池的正极
B.铂不断溶解
C.电池工作时实现机械能向电能再向化学能转化
D.稀溴水为电解质溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com