
【题目】下列图示与对应的叙述相符的是

A.图1表示0.001 mol·L一1盐酸滴定0.001 mol·L一1NaOH溶液的滴定曲线
B.图2所示,石墨的熔点比金刚石低
C.图3表示的是Al3+与OH一反应时含铝微粒浓度变化曲线,图中a区域的物质是Al(OH)3
D.图4所示,图中的阴影部分面积的含义是「v(正)一v(逆)〕
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.4CuO(s)=2Cu2O(s)+O2(g)在室温下不能自发进行,说明该反应△H>0
B.向稀醋酸中加入醋酸钠固体,溶液pH升高的主要原因是醋酸钠水解呈碱性
C.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN大
D.H2S(g)+FeO(s)![]() FeS(s)+H2O(g),其他条件不变时增大压强,反应速率V正(H2S)和H2S的平衡转化率均增大
FeS(s)+H2O(g),其他条件不变时增大压强,反应速率V正(H2S)和H2S的平衡转化率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、50 mL 0.50mol/L盐酸、50 mL 0.55mol/LNaOH溶液,实验尚缺少的玻璃用品是____、____。
(2)NaOH稍过量的原因是_______。
(3)实验中若改用60 mL 0.50 mol/L盐酸和50 mL 0.55 mol/LNaOH溶液进行上述反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热____(填“相等”或“不相等”),理由是________。
(4)他们记录的实验数据如下:
实 验 用 品 | 溶液温度 | ||
t1 | t2 | ||
① | 50 mL 0.55mol/LNaOH溶液 | 20 ℃ | 23.3 ℃ |
50 mL 0.50mol/L盐酸 | |||
② | 50 mL 0.55mol/LNaOH溶液 | 20 ℃ | 23.5 ℃ |
50 mL 0.50mol/L盐酸 | |||
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 J/(℃g),各物质的密度均为1 g/cm3。根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:____。
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热(ΔH)______(填“偏大”“偏小”或“不变”),其原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂,实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图,主要步骤如下:

步骤1三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15mL液溴。
步骤2缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性;
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的作用是______,实验中不能用干燥空气代替干燥N2,原因是______。
(2)如将装置B改为装置C,可能会导致的后果是______。

(3)步骤3中,第一次过滤除去的物质是______。
(4)有关步骤4的说法,正确的是______。
A.可用95%的乙醇代替苯溶解粗品
B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯
D.该步骤的目的是除去乙醚和可能残留的溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.氢气的燃烧热为285 . 5KJ/mol ,则电解水的热化学方程式为2H2O(l)![]() 2H2(g)+O2(g) △H=+285.5kJ/mol
2H2(g)+O2(g) △H=+285.5kJ/mol
B.已知H+(aq)+OH-(aq)=H2O(l) △H= -57.3 kJ/mol,则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热△H=2 ×(-57.3) kJ/mol
C.在CO2中,Mg燃烧生成MgO和C,该反应中化学能全都转化为热能
D.已知AX3的熔点和沸点分别为一93 .6℃和76℃, AX5的熔点为167℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 KJ/mol。该反应的热化学方程式为AX3(l)+ X2(g)= AX5(s) △H= 一123.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,设计并完成了如下实验。由此可知原溶液中

A. 原溶液中c(Fe3+)=0.1 mol·L-1
B. 要确定原溶液中是否含有Fe2+,其操作如下:取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+
C. SO42-、NH4+、Na+一定存在,CO32-、Al3+一定不存在
D. 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10molL-1NaOH溶液分别滴定20.00mL0.10molL-1的HX和HY溶液,滴定曲线如图所示。下列说法正确的是( )
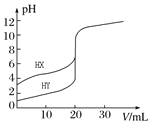
A.pH=7时,滴定HX消耗NaOH溶液体积等于20.00mL
B.将上述HX、HY溶液各加水稀释10倍,稀释后溶液的pH:pH(HY)>pH(HX)
C.当NaOH溶液体积为20.00mL时,HX溶液中离子浓度:c(Na+)>c(X-)>c(H+)>c(OH-)
D.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,c(H+)+c(HX)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿![]() 主要成分为
主要成分为![]() ,还有少量的
,还有少量的![]() 等杂质
等杂质![]() 提取氧化铝作冶炼铝的原料,提取的操作过程如下:
提取氧化铝作冶炼铝的原料,提取的操作过程如下:
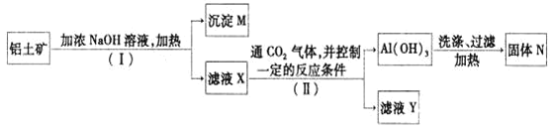
(1)![]() 和II步骤中分离溶液和沉淀的操作为_________,所用到的玻璃仪器是:________;
和II步骤中分离溶液和沉淀的操作为_________,所用到的玻璃仪器是:________;
(2)沉淀M中除含有泥沙外,一定还含有_______,固体N是_______;
(3)滤液X中,含铝元素的溶质的化学式为______,它属于_____![]() 填“酸”、“碱”或“盐”
填“酸”、“碱”或“盐”![]() 类物质;
类物质;
(4)实验室里常往![]() 溶液中加入___________
溶液中加入___________![]() 填“氨水”或“NaOH溶液”
填“氨水”或“NaOH溶液”![]() 来制取
来制取![]() ;
;
(5)将铝粉和氧化铁的混合物点燃,反应放出大量的热量,生成的液态的铁用来焊接铁轨。请写出反应的化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入![]() 的氢氧化钠浓溶液中,加热少许时间后,溶液中形成NaCl、NaClO、
的氢氧化钠浓溶液中,加热少许时间后,溶液中形成NaCl、NaClO、![]() 共存体系(不考虑氯气和水的反应)。下列说法正确的是
共存体系(不考虑氯气和水的反应)。下列说法正确的是
A.若反应中转移的电子为n mol,则![]()
B.溶液中![]() 可能为
可能为![]()
C.与NaOH反应的氯气物质的量:![]()
D.当溶液中![]() 时,反应的离子方程式为:
时,反应的离子方程式为:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com