
【题目】关于下列图像的叙述正确的是

A.图I表示:反应I2(g)+H2(g) ![]() 2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度
2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度
B.图Ⅱ表示:25℃时,用醋酸溶液滴定40.00 mL 0.1000 mol·L-1NaOH溶液的滴定曲线,其中c(CH3COOH)=0.1000mol/L
C.图Ⅲ表示:反应2NO2(g) ![]() N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2
N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2
D.图Ⅳ表示:25℃时,分别稀释等体积,等pH的NaOH溶液与氨水时的pH变化,其中曲线a对应氨水
【答案】D
【解析】
试题分析:A.I2(g)+H2(g) ![]() 2HI(g) 的反应是放热反应。升高温度,正、逆化学反应速率都加快。由于温度对吸热反应影响较大,所以根据平衡移动原理,化学平衡向吸热反应方向移动。所以逆反应速率增大的多。所以平衡向逆反应方向移动。错误。B.在25℃时,用醋酸溶液滴定40.00 mL 0.1000 mol·L-1NaOH溶液,当恰好完全反应时, n(NaOH)=n(CH3COOH) .但由于生成的CH3COONa是强碱弱酸盐,水解使溶液的pH>7。若使溶液的pH=7,则CH3COOH应该稍微过量。因此c(CH3COOH) >0.1000mol/L.错误。C.由图像可以看出:在压强不变时,升高温度,N2O4的含量降低。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,逆反应方向为吸热反应,所以 该反应的正反应为放热反应。△H<0。在温度不变时,增大压强,平衡正向移动,N2O4的含量增大。所以p1>p2.错误。D. 25℃时,等pH的NaOH溶液与氨水,由于NaOH为强碱,完全电离,而NH3·H2O是弱碱,部分电离,因此c(NH3·H2O)>c(NaOH).当稀释相同的倍数时,由于NH3·H2O会继续电离产生OH-。因此溶液的pH变化较小。因此其中曲线a对应氨水。正确。
2HI(g) 的反应是放热反应。升高温度,正、逆化学反应速率都加快。由于温度对吸热反应影响较大,所以根据平衡移动原理,化学平衡向吸热反应方向移动。所以逆反应速率增大的多。所以平衡向逆反应方向移动。错误。B.在25℃时,用醋酸溶液滴定40.00 mL 0.1000 mol·L-1NaOH溶液,当恰好完全反应时, n(NaOH)=n(CH3COOH) .但由于生成的CH3COONa是强碱弱酸盐,水解使溶液的pH>7。若使溶液的pH=7,则CH3COOH应该稍微过量。因此c(CH3COOH) >0.1000mol/L.错误。C.由图像可以看出:在压强不变时,升高温度,N2O4的含量降低。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,逆反应方向为吸热反应,所以 该反应的正反应为放热反应。△H<0。在温度不变时,增大压强,平衡正向移动,N2O4的含量增大。所以p1>p2.错误。D. 25℃时,等pH的NaOH溶液与氨水,由于NaOH为强碱,完全电离,而NH3·H2O是弱碱,部分电离,因此c(NH3·H2O)>c(NaOH).当稀释相同的倍数时,由于NH3·H2O会继续电离产生OH-。因此溶液的pH变化较小。因此其中曲线a对应氨水。正确。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】某化工厂以丙烯、乙烯为原料进行化工生产的主要流程如下。下列有关说法错误的是( )
![]() ,其中
,其中![]()
A.反应①与反应④均是取代反应
B.反应②与反应③均是加成反应
C.反应②中产物的结构简式为CH2BrCH2CHClBr
D.反应③、④表明硫酸是乙烯与水反应的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,在容积为2 L的3个恒容密闭容器中发生反应:3A(g)+B(g)![]() nC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
nC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物的投入量 | 3 mol A、2 mol B | 6 mol A、4 mol B | 2 mol C |
达到平衡的时间/min | 5 | 8 | |
A的浓度/mol·L-1 | c1 | c2 | |
C的体积分数% | w1 | w3 | |
混合气体的密度/g·L-1 | ρ1 | ρ2 |
下列说法正确的是( )
A. 若n<4,则2c1<c2
B. 若n=4,则w3=w1
C. 无论n的值是多少均有2ρ1=ρ2
D. 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种化学名为 2,4,4—三氯—2— 羟基—二苯醚的物质(如下图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用。则下列有关说法中正确的是 ( )

A. 该物质与 FeCl3溶液混合后不显色
B. 该物质中所有原子一定处于同一平面
C. 该物质苯环上的一溴取代物有 6 种
D. 物质的分子式为 C12H6Cl3O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予美国固体物理学家约翰·巴尼斯特·古迪纳(JohnB.Goodenough)、英国化学家斯坦利·威廷汉(StanleyWhittingham)和日本化学家吉野彰(AkiraYoshino),以表彰他们发明锂离子电池方面做出的贡献。全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )
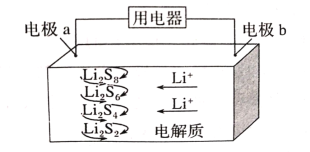
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B.电池工作时,外电路中流过0.02mol电子,负极材料减重0.14g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末![]() 含
含![]() 、
、![]() 、
、![]() 、FeO等物质
、FeO等物质![]() 某课题小组以此粉末为原料,设计如图1工艺流程对资源进行回收,得到
某课题小组以此粉末为原料,设计如图1工艺流程对资源进行回收,得到![]() 和硫酸铁铵矾:
和硫酸铁铵矾:

已知:
Ⅰ![]() 酸性条件下,铈在水溶液中有
酸性条件下,铈在水溶液中有![]() 、
、![]() 两种主要存在形式,
两种主要存在形式,![]() 易水解,
易水解,![]() 有较强氧化性;
有较强氧化性;
Ⅱ![]() 不溶于稀硫酸;
不溶于稀硫酸;
Ⅲ![]() 硫酸铁铵矾
硫酸铁铵矾![]() 广泛用于水的净化处理.
广泛用于水的净化处理.
![]() 滤液A的主要成分______
滤液A的主要成分______![]() 填写化学式
填写化学式![]() .
.
![]() 写出反应
写出反应![]() 的离子方程式______.
的离子方程式______.
![]() 反应
反应![]() 之前要洗涤滤渣B,对滤渣B进行洗涤的实验操作方法是______
之前要洗涤滤渣B,对滤渣B进行洗涤的实验操作方法是______
![]() 稀土元素的提纯,还可采用萃取法.已知化合物HT作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为
稀土元素的提纯,还可采用萃取法.已知化合物HT作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为![]() 水层
水层![]() 有机层
有机层![]() 有机层
有机层![]() 水层
水层![]() ,分液得到
,分液得到![]() 有机层
有机层![]() ,再加入
,再加入![]() 获得较纯的含
获得较纯的含![]() 的水溶液.可选择硫酸作反萃取剂的原因是______.
的水溶液.可选择硫酸作反萃取剂的原因是______.
![]() 用滴定法测定制得的
用滴定法测定制得的![]() 产品纯度.
产品纯度.

所用![]() 溶液在空气中露置一段时间后再进行滴定,则测得该
溶液在空气中露置一段时间后再进行滴定,则测得该![]() 产品的质量分数______
产品的质量分数______![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]()
![]() 已知
已知![]() 沉淀的pH范围:
沉淀的pH范围:![]() ,
,![]() 沉淀的pH范围:
沉淀的pH范围:![]() ,
,![]() 沉淀的pH范围:
沉淀的pH范围:![]() ,
,![]() 时
时![]() 能溶于NaOH溶液生成
能溶于NaOH溶液生成![]() 现用
现用![]() 溶液
溶液![]() 含有
含有![]() 杂质
杂质![]() 来制备硫酸铁铵矾.实验中可选用的试剂:
来制备硫酸铁铵矾.实验中可选用的试剂:![]() 溶液、
溶液、![]() 、NaOH溶液、饱和石灰水、稀
、NaOH溶液、饱和石灰水、稀![]() 溶液、稀盐酸.
溶液、稀盐酸.
实验步骤依次为:
![]() 向含有
向含有![]() 杂质的
杂质的![]() 溶液中,加入足量的NaOH溶液至
溶液中,加入足量的NaOH溶液至![]() ,______;
,______;
![]() ______;
______;
![]() 向
向![]() 中得到的溶液中加入硫酸铵溶液,______、______过滤、洗涤、常温晾干,得硫酸铁铵晶体
中得到的溶液中加入硫酸铵溶液,______、______过滤、洗涤、常温晾干,得硫酸铁铵晶体![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种重要的化工原料,一种利用低品位铜矿![]() 主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等
主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等![]() 为原料制取CuCl的工艺流程如下:
为原料制取CuCl的工艺流程如下:
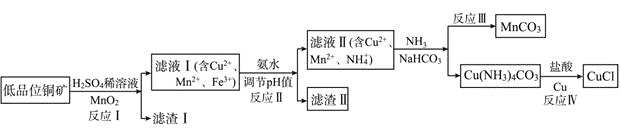
(1)反应Ⅰ“浸取”前需将铜矿粉碎的目的是___________________________;
(2)滤渣Ⅰ的成分除S和![]() 外还含有___________,反应 Ⅰ中
外还含有___________,反应 Ⅰ中![]() 的作用为_______________
的作用为_______________
(3)已知生成氢氧化物的pH如下表,则反应Ⅱ“中和”时,用氨水调pH的范围是______________。
物质 |
|
|
|
开始沉淀pH |
|
|
|
完全沉淀pH |
|
|
|
(4)检验滤液Ⅱ中是否含有![]() 所需要的试剂是:______________
所需要的试剂是:______________
(5)①反应Ⅲ中生成难溶![]() 的离子方程式:______________
的离子方程式:______________
②反应Ⅳ所对应的化学方程式:______________________________
(6) CuCl的定量分析
步骤1.取样品0.7500g和30.0mL 1.0mol·L-1过量的FeCl3溶液置于250mL的锥形瓶中,不断摇动。
步骤2.待样品溶解后,平均分为3份,用0.1000mol·L-1 Ce(SO4)2标准溶液进行滴定。
三次实验测得数据如下表
序号 | 1 | 2 | 3 |
起始读数 |
|
|
|
终点读数 |
|
|
|
已知:![]() ;
;![]() 。
。
①数据处理:计算得CuCl的纯度为_________![]()
②误差下列操作会使测定结果偏高的是______________
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线
C.0.1000mol·L-1硫酸铈溶液久置后浓度变小
D.滴定前滴定管尖嘴无气泡,滴定后产生气泡
E.用量筒取10.0mL 1.0mol·L-1的![]() 溶液时仰视刻度线
溶液时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.4CuO(s)=2Cu2O(s)+O2(g)在室温下不能自发进行,说明该反应△H>0
B.向稀醋酸中加入醋酸钠固体,溶液pH升高的主要原因是醋酸钠水解呈碱性
C.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN大
D.H2S(g)+FeO(s)![]() FeS(s)+H2O(g),其他条件不变时增大压强,反应速率V正(H2S)和H2S的平衡转化率均增大
FeS(s)+H2O(g),其他条件不变时增大压强,反应速率V正(H2S)和H2S的平衡转化率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、50 mL 0.50mol/L盐酸、50 mL 0.55mol/LNaOH溶液,实验尚缺少的玻璃用品是____、____。
(2)NaOH稍过量的原因是_______。
(3)实验中若改用60 mL 0.50 mol/L盐酸和50 mL 0.55 mol/LNaOH溶液进行上述反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热____(填“相等”或“不相等”),理由是________。
(4)他们记录的实验数据如下:
实 验 用 品 | 溶液温度 | ||
t1 | t2 | ||
① | 50 mL 0.55mol/LNaOH溶液 | 20 ℃ | 23.3 ℃ |
50 mL 0.50mol/L盐酸 | |||
② | 50 mL 0.55mol/LNaOH溶液 | 20 ℃ | 23.5 ℃ |
50 mL 0.50mol/L盐酸 | |||
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 J/(℃g),各物质的密度均为1 g/cm3。根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:____。
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热(ΔH)______(填“偏大”“偏小”或“不变”),其原因是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com