
【题目】下列依据热化学方程式得出的结论正确的是
A.已知C(石墨,s)![]() C(金刚石,s) △H=+1.9 kJ/mol,则金刚石比石墨稳定
C(金刚石,s) △H=+1.9 kJ/mol,则金刚石比石墨稳定
B.氢气的燃烧热为-285.5 kJ·mol-1,则水电解的热化学方程式为:2H2O(l)=2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H =-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g)放热19.3 kJ,热化学方程式为:N2(g)+3H2(g)=2NH3(g) ΔH=-38.6 kJ·mol-1
【答案】C
【解析】
A.石墨转化为金刚石吸收能量,说明金刚石的能量比石墨高,物质含有的能量越高,物质的稳定性就越弱,因此石墨比金刚石稳定,A错误;
B.氢气的燃烧热为-285.5 kJ·mol-1,表示1molH2完全燃烧产生液态水,放出285.kJ的热,则水电解的热化学方程式为:2H2O(l)=2H2(g)+O2(g) ΔH=+571 kJ/mol,B错误;
C.浓硫酸溶于水会放出热量,所以将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ,C正确;
D.N2和H2反应产生NH3的反应为可逆反应,反应物不能完全转化为生成物,将1molN2与3molH2放在密闭容器中充分反应生成NH3,放出的热量不是38.6 kJ,反应的物质与反应热不对应,D错误;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】T ℃时,在容积为2 L的3个恒容密闭容器中发生反应:3A(g)+B(g)![]() nC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
nC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物的投入量 | 3 mol A、2 mol B | 6 mol A、4 mol B | 2 mol C |
达到平衡的时间/min | 5 | 8 | |
A的浓度/mol·L-1 | c1 | c2 | |
C的体积分数% | w1 | w3 | |
混合气体的密度/g·L-1 | ρ1 | ρ2 |
下列说法正确的是( )
A. 若n<4,则2c1<c2
B. 若n=4,则w3=w1
C. 无论n的值是多少均有2ρ1=ρ2
D. 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种重要的化工原料,一种利用低品位铜矿![]() 主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等
主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等![]() 为原料制取CuCl的工艺流程如下:
为原料制取CuCl的工艺流程如下:
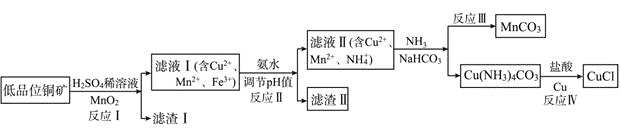
(1)反应Ⅰ“浸取”前需将铜矿粉碎的目的是___________________________;
(2)滤渣Ⅰ的成分除S和![]() 外还含有___________,反应 Ⅰ中
外还含有___________,反应 Ⅰ中![]() 的作用为_______________
的作用为_______________
(3)已知生成氢氧化物的pH如下表,则反应Ⅱ“中和”时,用氨水调pH的范围是______________。
物质 |
|
|
|
开始沉淀pH |
|
|
|
完全沉淀pH |
|
|
|
(4)检验滤液Ⅱ中是否含有![]() 所需要的试剂是:______________
所需要的试剂是:______________
(5)①反应Ⅲ中生成难溶![]() 的离子方程式:______________
的离子方程式:______________
②反应Ⅳ所对应的化学方程式:______________________________
(6) CuCl的定量分析
步骤1.取样品0.7500g和30.0mL 1.0mol·L-1过量的FeCl3溶液置于250mL的锥形瓶中,不断摇动。
步骤2.待样品溶解后,平均分为3份,用0.1000mol·L-1 Ce(SO4)2标准溶液进行滴定。
三次实验测得数据如下表
序号 | 1 | 2 | 3 |
起始读数 |
|
|
|
终点读数 |
|
|
|
已知:![]() ;
;![]() 。
。
①数据处理:计算得CuCl的纯度为_________![]()
②误差下列操作会使测定结果偏高的是______________
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线
C.0.1000mol·L-1硫酸铈溶液久置后浓度变小
D.滴定前滴定管尖嘴无气泡,滴定后产生气泡
E.用量筒取10.0mL 1.0mol·L-1的![]() 溶液时仰视刻度线
溶液时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.4CuO(s)=2Cu2O(s)+O2(g)在室温下不能自发进行,说明该反应△H>0
B.向稀醋酸中加入醋酸钠固体,溶液pH升高的主要原因是醋酸钠水解呈碱性
C.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN大
D.H2S(g)+FeO(s)![]() FeS(s)+H2O(g),其他条件不变时增大压强,反应速率V正(H2S)和H2S的平衡转化率均增大
FeS(s)+H2O(g),其他条件不变时增大压强,反应速率V正(H2S)和H2S的平衡转化率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是( )
A. 用湿润的pH试纸测稀碱液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D. 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1的(NH4)2SO4溶液中:Na+、Cu2+、Cl-、OH-
B.![]() =10-12的溶液中:Na+、NO3-、AlO2-、CO32-
=10-12的溶液中:Na+、NO3-、AlO2-、CO32-
C.水电离的c(H+) =1×10-13mol·L-1溶液中:Na+、K+、NO3-、HCO3-
D.0.1 mol·L-1的FeCl3溶液中:K+、Mg2+、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各实验装置图的叙述中,正确的是( )
A.装置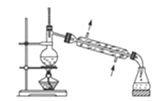 常用于分离互不相溶的液体混合物
常用于分离互不相溶的液体混合物
B.装置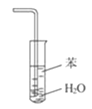 可用于吸收NH3,并防止倒吸
可用于吸收NH3,并防止倒吸
C.图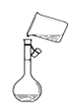 是将溶解好的溶液转移到容量瓶中
是将溶解好的溶液转移到容量瓶中
D.图 可观察NaCl的焰色反应
可观察NaCl的焰色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、50 mL 0.50mol/L盐酸、50 mL 0.55mol/LNaOH溶液,实验尚缺少的玻璃用品是____、____。
(2)NaOH稍过量的原因是_______。
(3)实验中若改用60 mL 0.50 mol/L盐酸和50 mL 0.55 mol/LNaOH溶液进行上述反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热____(填“相等”或“不相等”),理由是________。
(4)他们记录的实验数据如下:
实 验 用 品 | 溶液温度 | ||
t1 | t2 | ||
① | 50 mL 0.55mol/LNaOH溶液 | 20 ℃ | 23.3 ℃ |
50 mL 0.50mol/L盐酸 | |||
② | 50 mL 0.55mol/LNaOH溶液 | 20 ℃ | 23.5 ℃ |
50 mL 0.50mol/L盐酸 | |||
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 J/(℃g),各物质的密度均为1 g/cm3。根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:____。
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热(ΔH)______(填“偏大”“偏小”或“不变”),其原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10molL-1NaOH溶液分别滴定20.00mL0.10molL-1的HX和HY溶液,滴定曲线如图所示。下列说法正确的是( )
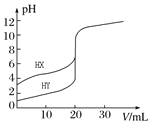
A.pH=7时,滴定HX消耗NaOH溶液体积等于20.00mL
B.将上述HX、HY溶液各加水稀释10倍,稀释后溶液的pH:pH(HY)>pH(HX)
C.当NaOH溶液体积为20.00mL时,HX溶液中离子浓度:c(Na+)>c(X-)>c(H+)>c(OH-)
D.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,c(H+)+c(HX)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com