
����Ŀ��Ϊ�������ѭ��Ч�ʺ��ȶ��ԣ���ѧ�ҽ���������ά�����״Zn(3DZn)���Ը�Ч����ZnO���ص㣬����˲���ǿ���Ե���ʵ�3DZnNiOOH���ε�أ��ṹ��ͼ��ʾ����ط�ӦΪZn��2NiOOH��H2O ![]() ZnO��2Ni(OH)2������˵����ȷ����
ZnO��2Ni(OH)2������˵����ȷ����

A.�ŵ�ʱ����������pH����
B.�ŵ������OH��ͨ����Ĥ�Ӹ���������������
C.���ʱ3DZn�缫Ӧ�����ֱ����Դ����������
D.���ʱ������ӦΪ��Ni(OH)2��OH����e��=NiOOH��H2O
���𰸡�D
��������
���ݵ�ط�Ӧ��Ԫ�ػ��ϼ۵ı仯��֪���ŵ�ʱ��ZnΪ������NiOOHΪ�������������Һ�ʼ��ԣ� �����ĵ缫��ӦΪ��Zn(s)+2OH-(aq)-2e-=ZnO(s)+H2O(l)�������ĵ缫��ӦΪ��NiOOH(s)��H2O(l)+e��=Ni(OH)2(s)��OH��(aq)�����ʱ�����ķ�ӦΪNi(OH)2(s)��OH��(aq)-e��=NiOOH(s)��H2O(l)�������ĵ缫��ӦΪ��ZnO(s)+H2O(l)+2e-= Zn(s)+2OH-(aq)���ŵ�ʱ�������Һ�����������ƶ����ݴ˽��з����жϡ�
A. �ŵ�ʱ�����ĵ缫��ӦΪ��Zn(s)+2OH-(aq)-2e-=ZnO(s)+H2O(l)��c(OH-)��С����˸���������pH���ͣ�A�����
B. �ŵ�ʱ�������Һ�����������ƶ�����˷ŵ������OH��ͨ����Ĥ����������������B�����
C. ���ʱ�����ĵ缫��ӦΪ��ZnO(s)+H2O(l)+2e-= Zn(s)+2OH-(aq)�����3DZn�缫Ӧ�����ֱ����Դ�ĸ���������C�����
D. ���ʱ������ӦΪ��Ni(OH)2��OH����e��=NiOOH��H2O��D����ȷ��
��ѡD��


 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д� ����������ϵ�д�
����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���Ӧ����ʽ��д��ȷ���ǣ� ��
A.������������ȡ����Ӧ��CH4��Cl2![]() CH2Cl2��H2
CH2Cl2��H2
B.�������Ҵ���������Ӧ��CH3COOH��CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
C.�Ҵ��Ĵ�������Ӧ��CH3CH2OH��O2![]() CH3CHO��H2O
CH3CHO��H2O
D.���������������Ӧ��![]() ��HNO3
��HNO3![]()
![]() ��H2O
��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ȼ�ѧ����ʽ�ó��Ľ�����ȷ����![]()
A.��֪![]()
![]() ����
����![]() gNaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�������С��
gNaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�������С��![]()
B.��֪![]()
![]() ��������1mol������ȫȼ�շų�
��������1mol������ȫȼ�շų�![]() kJ������
kJ������
C.��֪![]()
![]() ��
��![]()
![]() ����
����![]()
D.��֪P![]() ���ף�
���ף�![]()
![]() ���ף�
���ף�![]() ������ױȺ����ȶ�
������ױȺ����ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��̽��H2��ԭCu2O�����װ����ͼ������˵������ȷ����( )
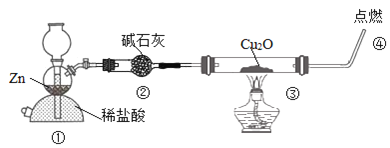
A.װ�â�Ҳ��������ȡCO2
B.װ�âڵ�����֮һ�Ǹ�������
C.ͨ�����ڹ�����ɫ�ı仯�жϷ�Ӧ�Ƿ���ȫ
D.ʵ���������Ϩ��ƾ��ƺ�ֹͣͨ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼���á��ǽ��������й��ķ�չ����
(1) ��֪���� CH4(g)+H2O(g)=CO(g)+3H2(g) ��H1=+206.1kJ/mol
�� 2H2(g)+CO(g)=CH3OH(l) ��H2=-128.3kJ/mol
�� 2H2(g)+O2(g)=2H2O(g) ��H3=-481.9kJ/mol
�����£��ں��ʴ����������£�����CH4��O2һ���ϳ�Һ̬CH3OH���Ȼ�ѧ����ʽΪ____��
(2) ������(CH3OCH3)�������Դ�����úϳ����ϳɶ����ѵ�ԭ����2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) ��H<0����һ�������£��ڷ�Ӧ��CO��ƽ��ת������(CO)���¶�(T)��Ͷ�ϱ�n(H2)/n(CO)�Ĺ�ϵ��ͼ1��ʾ��ƽ�ⳣ��K���¶�(T)�Ĺ�ϵ��ͼ2��ʾ��
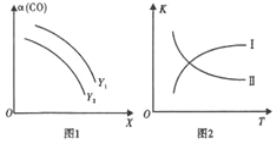
��ͼ1�У�X����____��Y1____Y2 (�>����<����=��)��
��ͼ2�У�����____(��I��II)����ƽ�ⳣ���仯���ɡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ�����У���ȷ����
A.������������������Ʒֱ���ȫȼ�գ�ǰ�߷ų���������
B.a ����b kPa�£���0.5 mol O2��1.5 mol H2�����ܱ������г�ַ�Ӧ����H2O(g)������c kJ�����Ȼ�ѧ����ʽΪ2H2(g)��O2(g)��2H2O(g) ��H����2c kJ��mol��1
C.���³�ѹ�£�2.8 g CO������ȫȼ�շų�������Ϊ28.26 kJ�����ʾCOȼ���ȵ��Ȼ�ѧ����ʽΪ2CO(g)��O2(g)��2CO2(g) ��H����565.2 kJ��mol��1
D.ϡ������Һ��ϡNaOH��Һ��Ӧ���к���Ϊ57.3 kJ��mol��1����ϡ������Һ��ϡNaOH��Һ��Ӧ���Ȼ�ѧ����ʽ�ɱ�ʾΪCH3COOH(aq)��NaOH(aq)��CH3COONa(aq)��H2O(l) ��H����57.3 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�����(S2Cl2)��һ����Ҫ�Ļ���ԭ�ϣ��������������ı��������ȷ�ճ�������Ӳ�����ʡ��������Ͽ�֪S2Cl2�����������ʣ�
�������� | ���� | ɫ̬ | �ӷ��� | �۵� | �е� |
�綾 | ���ɫҺ�� | �ӷ� | ��76�� | 138�� | |
��ѧ���� | ��300��������ȫ�ֽ⣻ ��S2Cl2+Cl2 �������Ȼ�������Ӵ���������ȼ�յ�Σ�գ� �����Ȼ���ˮ�ֽ���ȣ��ų���ʴ�������� | ||||
��1����ȡ����S2Cl2
ʵ���ҿ�������������������110��140�淴Ӧ�Ƶ�S2Cl2��Ʒ��
������m������Ϊ___��װ��F���Լ���������___��
��װ������˳��A��___��E��D��
��ʵ��ǰ��K1��ͨ��һ��ʱ��ĵ����ž�װ���ڿ�����ʵ�����ֹͣ���Ⱥ���ͨ��һ��ʱ��ĵ�������Ŀ����___��
��Ϊ�����S2Cl2�Ĵ��ȣ�ʵ��Ĺؼ��ǿ��ƺ��¶Ⱥ�___��
��2����S2Cl2��ˮǿ�ҷ�Ӧ�������������������һ������X��ʹƷ����Һ��ɫ�����Ⱥ��ָֻ�ԭ״���ҷ�Ӧ������ֻ��һ��Ԫ�ػ��ϼ۷����仯��д���÷�Ӧ�Ļ�ѧ����ʽ___��
�ڼ�ͬѧΪ����֤������������ˮ�����ɵ���������ͨ����������ϡ����Ļ����Һ��Ʒ����Һ��NaOH ��Һ���÷���___������С������С�����ԭ����___��
��3��ijͬѧΪ�˲ⶨS2Cl2��ˮ��Ӧ�����ɵ�����X�ڻ�������е�������������������ʵ�鷽����

��W��Һ������___(����)��
a��H2O2��Һ b��KMnO4��Һ(�����ữ) c����ˮ
�ڸû������������X���������Ϊ____(�ú�V��m��ʽ�ӱ�ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ������ ��
A. ���������Һ�ⶨNaOH��ҺŨ�ȵζ�ʵ���У��ζ�ǰ�����ݶ��ζ��������ݣ���ʹ�ⶨֵƫ��
B. �����¸ֹ���ֱ����Դ���������������������ֹ�
C. ��֪��101KPa�£�1gH2ȼ������ˮ�����ų�121kJ���������Ȼ�ѧ����ʽΪ��2H2(g)+O2(g)=2H2O(g)��H=-484kJ��mol-1
D. 25�棬101kPaʱ��ǿ����ǿ���ϡ��Һ�����кͷ�Ӧ���к���Ϊ57.3kJ��mol-1,��ʾϡH2SO4��KOH��Һ��Ӧ���к��ȵ��Ȼ�ѧ����ʽΪ��H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l)��H=-114.6kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A.16g O3���е���ԭ����ΪNA
B.���³�ѹ�£�22.4L SO2���еķ�����ΪNA
C.1molMg���Mg2+ʱ��ʧȥ���ӵ���ĿΪNA
D.1L 1mol��L-1H2SO4��Һ�к�H+����ĿΪNA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com