
【题目】下列依据热化学方程式得出的结论正确的是![]()
A.已知![]()
![]() ,则含
,则含![]() gNaOH的稀溶液与稀醋酸完全中和,放出的热量小于
gNaOH的稀溶液与稀醋酸完全中和,放出的热量小于![]()
B.已知![]()
![]() ,则标况下1mol氢气完全燃烧放出
,则标况下1mol氢气完全燃烧放出![]() kJ的热量
kJ的热量
C.已知![]()
![]() ,
,![]()
![]() ,则
,则![]()
D.已知P![]() 白磷,
白磷,![]()
![]() 红磷,
红磷,![]() ,则白磷比红磷稳定
,则白磷比红磷稳定
【答案】A
【解析】
A.中和热是指稀的强酸和强碱溶液发生中和反应生成1mol水时所放出的热量,醋酸是弱酸,其电离过程是吸热过,![]() 即1molNaOH的稀溶液与稀醋酸完全中和,放出小于
即1molNaOH的稀溶液与稀醋酸完全中和,放出小于![]() kJ的热量,故A正确;
kJ的热量,故A正确;
B.根据热化学方程式,2mol氢气燃烧生成气态水放出483.6kJ的热量,则1mol氢气燃烧生成气态水放出241.8kJ的热量,标况下水不是气体,所以标况下1mol氢气完全燃烧放出的热量不是241.8kJ,故B错误;
C.焦炭完全燃烧放出的热量高于不完全燃烧放出的热量,焓变是负值,即![]() ,故C错误;
,故C错误;
D.P ![]() 白磷,
白磷,![]()
![]() 红磷,
红磷,![]() ,所以红磷的能量低于白磷的能量,所以白磷不如红磷稳定,故D错误。
,所以红磷的能量低于白磷的能量,所以白磷不如红磷稳定,故D错误。
故选:A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3molA、0.1molC和一定量B三种气体。一定条件下发生反应,各物质浓度随时间变化如图甲所示[t0~t1阶段c(B)未画出]。图乙为t2时刻后改变条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种条件并且所用条件均不相同。已知t3~t4阶段为使用催化剂。下列说法正确的是( )

A. 若t1等于15s,生成物C在t0~t1时间段的平均反应速率为0.004mol/(Ls)
B. t4~t5阶段改变的条件为降低反应温度
C. B的起始的物质的量为0.02mol
D. t5~t6阶段可能是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末![]() 含
含![]() 、
、![]() 、
、![]() 、FeO等物质
、FeO等物质![]() 某课题小组以此粉末为原料,设计如图1工艺流程对资源进行回收,得到
某课题小组以此粉末为原料,设计如图1工艺流程对资源进行回收,得到![]() 和硫酸铁铵矾:
和硫酸铁铵矾:

已知:
Ⅰ![]() 酸性条件下,铈在水溶液中有
酸性条件下,铈在水溶液中有![]() 、
、![]() 两种主要存在形式,
两种主要存在形式,![]() 易水解,
易水解,![]() 有较强氧化性;
有较强氧化性;
Ⅱ![]() 不溶于稀硫酸;
不溶于稀硫酸;
Ⅲ![]() 硫酸铁铵矾
硫酸铁铵矾![]() 广泛用于水的净化处理.
广泛用于水的净化处理.
![]() 滤液A的主要成分______
滤液A的主要成分______![]() 填写化学式
填写化学式![]() .
.
![]() 写出反应
写出反应![]() 的离子方程式______.
的离子方程式______.
![]() 反应
反应![]() 之前要洗涤滤渣B,对滤渣B进行洗涤的实验操作方法是______
之前要洗涤滤渣B,对滤渣B进行洗涤的实验操作方法是______
![]() 稀土元素的提纯,还可采用萃取法.已知化合物HT作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为
稀土元素的提纯,还可采用萃取法.已知化合物HT作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为![]() 水层
水层![]() 有机层
有机层![]() 有机层
有机层![]() 水层
水层![]() ,分液得到
,分液得到![]() 有机层
有机层![]() ,再加入
,再加入![]() 获得较纯的含
获得较纯的含![]() 的水溶液.可选择硫酸作反萃取剂的原因是______.
的水溶液.可选择硫酸作反萃取剂的原因是______.
![]() 用滴定法测定制得的
用滴定法测定制得的![]() 产品纯度.
产品纯度.

所用![]() 溶液在空气中露置一段时间后再进行滴定,则测得该
溶液在空气中露置一段时间后再进行滴定,则测得该![]() 产品的质量分数______
产品的质量分数______![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]()
![]() 已知
已知![]() 沉淀的pH范围:
沉淀的pH范围:![]() ,
,![]() 沉淀的pH范围:
沉淀的pH范围:![]() ,
,![]() 沉淀的pH范围:
沉淀的pH范围:![]() ,
,![]() 时
时![]() 能溶于NaOH溶液生成
能溶于NaOH溶液生成![]() 现用
现用![]() 溶液
溶液![]() 含有
含有![]() 杂质
杂质![]() 来制备硫酸铁铵矾.实验中可选用的试剂:
来制备硫酸铁铵矾.实验中可选用的试剂:![]() 溶液、
溶液、![]() 、NaOH溶液、饱和石灰水、稀
、NaOH溶液、饱和石灰水、稀![]() 溶液、稀盐酸.
溶液、稀盐酸.
实验步骤依次为:
![]() 向含有
向含有![]() 杂质的
杂质的![]() 溶液中,加入足量的NaOH溶液至
溶液中,加入足量的NaOH溶液至![]() ,______;
,______;
![]() ______;
______;
![]() 向
向![]() 中得到的溶液中加入硫酸铵溶液,______、______过滤、洗涤、常温晾干,得硫酸铁铵晶体
中得到的溶液中加入硫酸铵溶液,______、______过滤、洗涤、常温晾干,得硫酸铁铵晶体![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
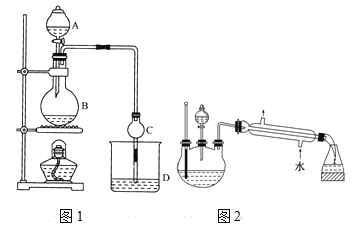
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图1所示,A中放有浓硫酸,B中放有无水乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl26C2H5OH。
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是____;用同位素18O示踪法确定反应产物水分子中氧原子的提供者,若用18O标记乙醇分子中的氧原子,请写出该化学方程式:________。
(2)球形干燥管C的作用是_______。若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是_______。
(3)采用分液法从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,然后加入无水氯化钙,分离出________;再加入无水硫酸钠除去水,然后进行________(填操作名称),以得较纯净的乙酸乙酯。
(4)上述实验中饱和碳酸钠溶液的作用是______(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(5)另一化学课外小组对上述实验进行了改进,设计了图2所示的装置,利用浓硫酸、乙醇、乙酸制取乙酸乙酯(铁架台、铁夹、加热装置均已略去)与图1所示装置相比,此装置的主要优点有(写出一条即可)________。
(6)该实验中用30g乙酸与46g乙醇反应,如果实际得到的乙酸乙酯的质量是26.4g,则该实验中乙酸乙酯的产率是______。(产率指的是某种生成物的实际产量与理论产量的比值。已知乙醇、乙酸、乙酸乙酯的相对分子质量分别为:46、60、88)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.4CuO(s)=2Cu2O(s)+O2(g)在室温下不能自发进行,说明该反应△H>0
B.向稀醋酸中加入醋酸钠固体,溶液pH升高的主要原因是醋酸钠水解呈碱性
C.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN大
D.H2S(g)+FeO(s)![]() FeS(s)+H2O(g),其他条件不变时增大压强,反应速率V正(H2S)和H2S的平衡转化率均增大
FeS(s)+H2O(g),其他条件不变时增大压强,反应速率V正(H2S)和H2S的平衡转化率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示中正确的是
A.电子式:Na:![]() :Na
:Na
B.中子数为22的钙原子:4222Ca
C.NaHSO3水解的离子方程式:HSO3-+H2O![]() H2SO3+OH-
H2SO3+OH-
D.H2CO3的电离方程式:H2CO3=H++HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1的(NH4)2SO4溶液中:Na+、Cu2+、Cl-、OH-
B.![]() =10-12的溶液中:Na+、NO3-、AlO2-、CO32-
=10-12的溶液中:Na+、NO3-、AlO2-、CO32-
C.水电离的c(H+) =1×10-13mol·L-1溶液中:Na+、K+、NO3-、HCO3-
D.0.1 mol·L-1的FeCl3溶液中:K+、Mg2+、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZnNiOOH二次电池,结构如图所示。电池反应为Zn+2NiOOH+H2O ![]() ZnO+2Ni(OH)2。下列说法正确的是
ZnO+2Ni(OH)2。下列说法正确的是

A.放电时负极附近的pH升高
B.放电过程中OH-通过隔膜从负极区移向正极区
C.充电时3DZn电极应与外接直流电源的正极相连
D.充电时阳极反应为:Ni(OH)2+OH--e-=NiOOH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,设计并完成了如下实验。由此可知原溶液中

A. 原溶液中c(Fe3+)=0.1 mol·L-1
B. 要确定原溶液中是否含有Fe2+,其操作如下:取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+
C. SO42-、NH4+、Na+一定存在,CO32-、Al3+一定不存在
D. 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com