
【题目】(1)请你将反应Cu+2FeCl3==CuCl2+2FeCl2设计成原电池并回答下列问题:
①写出电极反应式:正极_____________________;负极_________________________。
②画出你所设计的原电池简易装置图_________。
(2)该电池向外提供0.2mol 电子,负极材料的质量变化为________________________。
(3)利用反应2Cu+O2+2H2SO4==2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极的反应式为____________________________________________。
【答案】 2Fe3++2e-==2Fe2 Cu- 2e-=Cu2+ 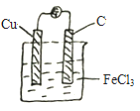 减少6.4g O2+4e-+4H+==2H2O
减少6.4g O2+4e-+4H+==2H2O
【解析】(1)①根据电池总反应式Cu+2FeCl3═CuCl2+2FeCl2可知,Cu失电子作负极,电极反应为:Cu-2e-═Cu2+;正极是三价铁离子得电子生成亚铁离子,电极反应为2Fe3++2e-═2Fe2+,故答案为:2Fe3++2e-═2Fe2+;Cu-2e-═Cu2+;
②根据原电池的总反应,可以选择FeCl3作电解质溶液,选用Cu和 C棒作电极,示意图为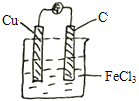 ,故答案为:
,故答案为: ;
;
(2)根据负极反应Cu-2e-=Cu2+可知消耗1mol铜,转移2mol电子,故转移0.2mol电子,消耗的铜为0.1mol,质量为0.1mol×64g/mol=6.4g,故答案为:减少6.4g;
(3)原电池正极发生的是化合价降低得电子的反应,根据方程式可知是O2得电子,另外,由于电解质溶液显酸性,所以正极的电极反应为:O2+4e-+4H+═2H2O,故答案为:O2+4e-+4H+═2H2O。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.热的浓HNO3能使蓝色石蕊试纸先变红后褪色
B.用HNO3和Na2S反应可以制得H2S气体
C.浓硫酸使蔗糖炭化,体现浓硫酸的的吸水性
D.热的浓硫酸可以用铁制器皿贮存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某溶液中含有Na+、Ba2+、Fe3+三种阳离子,那么溶液中的阴离子可能是( )
A. SO42- B. Cl- C. OH- D. CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如下:
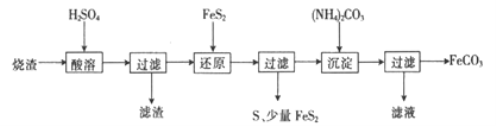
已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应ⅠW为
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+。
(1)反应Ⅰ中还原剂是_________
(2)滤渣的成分是_______(填名称)。
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是____________
(4)①配平反应的离子方程式: ![]() ____________
____________
②还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
离子 | 离子浓度(mol/L) | |
还原前 | 还原后 | |
Fe2+ | 0.10 | 2.50 |
SO42- | 3.50 | 3.70 |
则反应Ⅰ、Ⅱ中生成Fe2+的物质的量之比为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。
某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如下:


请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为___________________________________;
(2)支管B的作用是_________________________;
(3)步骤③中洗涤CaO2·8H2O的液体X的最佳选择是____________;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙___________的性质;
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①检查该装置气密性的方法是:_________________________________;
②使用________(填仪器名称)准确称取0.5000g样品,置于试管中加热使其完全分解,收集到33.60mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为________(保留4位有效数字);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体与无色气体,在合适条件下,它们可以按下面的流程进行反应.又知E溶液是无色的.请回答: 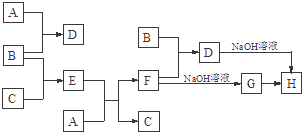
(1)写出E物质的化学式 .
(2)写出G→H的化学方程式 .
(3)写出B+F→D的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述中正确的是
A. 向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH=13
B. NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不同
C. 向醋酸溶液中加少量水稀释, 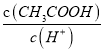 增大
增大
D. 向0.10mol/LNa2CO3溶液中通入少量CO2后:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1814年戴维发现了一氯化碘(沸点97.4℃),是一种红棕色易挥发液体,它的性质与卤素相似,可用作强氧化剂。干燥的氯气与碘反应可以制备ICl ,请用下列装置来制备ICl。

回答下列问题:
(1)制备ICl时,各装置接口的连接顺序是__________。
(2)能否将装置B 中的饱和食盐水换成水______(填“能”或“不能“);请用平衡移动的观点解释其理由________________。
(3)D装置中的烧瓶需放在冷水中,其目的是____________。
(4)将D装置得到的液态产物进步提纯可得到较纯净的IC1,提纯采取的方法是___________。
(5)ICl 与冷的NaOH稀溶液反应的离子方程式为______________。
(6)请设计实验证明IC1的氧化性比I2强:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应X+2Y=X2++2Y-的叙述中正确的是
A. X被氧化,Y是氧化剂 B. Y被还原,X是氧化剂,
C. X是还原剂,Y被氧化 D. Y被还原,X2+是还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com