
①称量a g样品,置于烧杯中;
②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250 mL溶液;
③准确量取25.00 mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全;
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦ 重复以上操作,至最后两次称得的质量不超过
请根据上面叙述,回答:
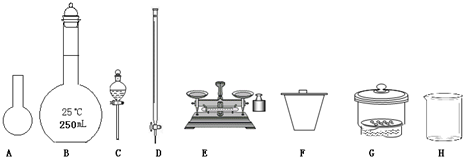
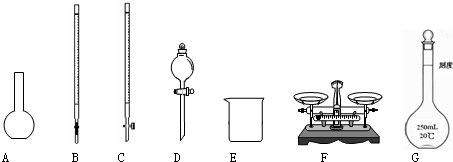
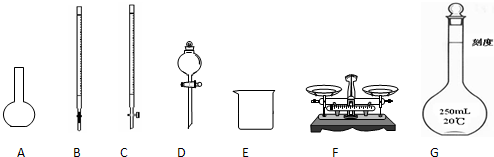
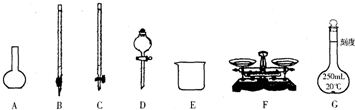
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E和__________(填字母)。

(2)写出步骤③中发生反应的离子方程式___________________________________。
(3)洗涤是洗去附着在沉淀上的_____(写离子符号),洗涤沉淀的操作是_________________。
(4)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为_______。
(5)该兴趣小组中甲学生认为:实验步骤③中不加入氯水,其余步骤不变,仍可达到目的。你认为甲学生的观点是否正确_______(填正确或错误),请说明理由:____________________。
(1)CFG
(2)2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
(3)![]() 、Cl-、OH-
、Cl-、OH-
向漏斗里注入蒸馏水,使水面没过滤渣,等水自然流完后,重复操作2—3次
(4)![]() ×2×
×2×![]() ÷a g×100%=
÷a g×100%=![]() ×100%
×100%
(5)正确 FeCl3、FeCl2溶液中加入过量氨水,生成Fe(OH)3和Fe(OH)2沉淀,在操作过程中Fe(OH)2会被空气进一步氧化生成Fe(OH)3,最后所得生成物只有Fe2O3,对实验结果无影响
解析:本题考查学生实验操作能力、实验设计能力和计算能力.
(1)步骤①称量a g样品,需要F托盘天平.步骤②准确配制250 mL溶液,需要G 250 mL容量瓶.步骤③准确量取25.00 mL步骤②中配得的溶液,置于烧杯中,需要使用滴定管来转移,因为FeCl3溶液显酸性,故使用C酸式滴定管.
(2)步骤③中,加入氯水是将Fe2+氧化成Fe3+,离子方程式为2Fe2++Cl2![]() 2Fe3++2Cl-.
2Fe3++2Cl-.
(3)实验中使用了氯水和过量的氨水,所以存在NH![]() 、Cl-、OH-这些离子,会附着在沉淀表面,洗涤的目的便是除去这些离子,防止产生实验误差.洗涤沉淀的操作是“向漏斗里注入蒸馏水,使水面没过滤渣,等水自然流完后,重复操作2—3次”.注意“重复操作2—3次”容易被遗漏,且此处不能用玻璃棒搅拌,防止将滤纸弄破,影响实验的进行.
、Cl-、OH-这些离子,会附着在沉淀表面,洗涤的目的便是除去这些离子,防止产生实验误差.洗涤沉淀的操作是“向漏斗里注入蒸馏水,使水面没过滤渣,等水自然流完后,重复操作2—3次”.注意“重复操作2—3次”容易被遗漏,且此处不能用玻璃棒搅拌,防止将滤纸弄破,影响实验的进行.
(4)若坩埚质量是W1,坩埚与加热后固体总质量是W2,可得固体Fe2O3的质量为(W2-W1),根据关系式 Fe2O3—2Fe计算[![]() ×2×
×2×![]() ]÷a g×100%得到样品中铁元素的质量分数为
]÷a g×100%得到样品中铁元素的质量分数为![]() ×100%.
×100%.
(5)氯水的作用是将Fe2+氧化成Fe3+,甲同学考虑到Fe(OH)2具有很强的还原性,在空气中也能被氧化成Fe(OH)3,故不加入氯水,这种观点是正确的.


科目:高中化学 来源: 题型:阅读理解
| (w2-w1)×112×10 |
| 160a |
| (w2-w1)×112×10 |
| 160a |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(W2-W1)g×
| ||||
| a g |
(W2-W1)g×
| ||||
| a g |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com