
【题目】红磷P(s)和 Cl2 发生反应生成 PCl3 和 PCl5,反应过程和能量关系如图所示。△H 表示生成 1mol产物的焓变数据。下列热化学方程式不正确的是
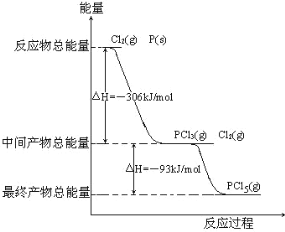
A.2P (s)+3Cl2 (g)=2PCl3 (g) △H=-612kJ·mol-1
B.PCl3 (g) =P (g)+ ![]() Cl2 (g) △H=306kJ·mol-1
Cl2 (g) △H=306kJ·mol-1
C.PCl5 (g)=PCl3 (g)+Cl2 (g) △H=93kJ·mol-1
D.2P (s)+5Cl2 (g)=2PCl5 (g) △H=-798kJ·mol-1
【答案】B
【解析】
A.P和Cl2反应生成PCl3的热化学方程式为P(s)+![]() Cl2(g)═PCl3(g) △H=-306 kJ/mol,则2P (s)+3Cl2 (g)=2PCl3 (g) △H=-612kJ·mol-1,故A正确;
Cl2(g)═PCl3(g) △H=-306 kJ/mol,则2P (s)+3Cl2 (g)=2PCl3 (g) △H=-612kJ·mol-1,故A正确;
B.P和Cl2反应生成PCl3的热化学方程式为P(s)+![]() Cl2(g)═PCl3(g) △H=-306 kJ/mol,则PCl3 (g) =P (s)+
Cl2(g)═PCl3(g) △H=-306 kJ/mol,则PCl3 (g) =P (s)+ ![]() Cl2 (g) △H=306kJ·mol-1,生成的P应该为固体,故B错误;
Cl2 (g) △H=306kJ·mol-1,生成的P应该为固体,故B错误;
C.其他条件不变,对于PCl5分解生成PCl3和Cl2的反应,热化学方程式为PCl5(g)=PCl3(g)+Cl2(g);△H=+93 kJ/mol,故C正确;
D.根据图中数据,可得P(s)+![]() Cl2(g)=PCl5(g) △H=-399kJ/mol,则有反应2P(s)+5Cl2(g)═2PCl5(g)对应的反应热△H=-798kJmol-1,故D正确;
Cl2(g)=PCl5(g) △H=-399kJ/mol,则有反应2P(s)+5Cl2(g)═2PCl5(g)对应的反应热△H=-798kJmol-1,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】下表列出了①⑤五种元素在周期表中的位置:

请按要求回答下列问题:
(1)元素④的原子结构示意图为______.
(2)元素①单质的电子式为______.
(3)元素②⑤的原子半径由大到小的顺序为(填元素符号)______,它们的最高价氧化物对应的水化物中,酸性最强的是______(填化学式).
(4)元素②的单质在氧气中燃烧的产物与二氧化碳反应的化学方程式为______;元素③的最高价氧化物与烧碱溶液反应的离子方程式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:p[![]() ]=-lg[
]=-lg[![]() ]。室温下,向0.10 mol/L HX溶液中滴加0.10 mol/LNaOH溶液,溶液pH随p[
]。室温下,向0.10 mol/L HX溶液中滴加0.10 mol/LNaOH溶液,溶液pH随p[![]() ]变化关系如图所示。下列说法正确的是
]变化关系如图所示。下列说法正确的是
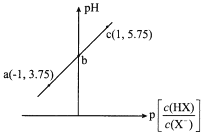
A.溶液中水的电离程度:a>b>c
B.c点溶液中:c(Na+)=10c(HX)
C.室温下NaX的水解平衡常数为10-4.75
D.图中b点坐标为(0,4.75)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.苯和四氯化碳都能使溴水褪色,但现象不同
B.甲烷与氯气在光照下最多能生成四种产物
C.邻二甲苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构
D.相同物质的量的乙醇和乙烯,消耗的氧气的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏伽德罗常数的值,下列说法正确的是
A.常温下,1mol 的 Fe 与足量的浓硫酸反应转移的电子数为 3NA
B.1L1mol·L-1 的 Na2CO3 溶液中含有碳酸根的数目为 NA
C.标准状况下,22.4L 的 Cl2 通入水中,转移的电子数为 NA
D.常温常压下,22.4L 的甲烷气体含有的氢原子的数目小于 4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在科研与生活中有重要应用。
(1)I2O5 是白色粉末状固体,在合成氨工业中常用 I2O5 来定量测量 CO 的含量。
已知:2I2 (s)+5O2 (g)=2I2O5 (s) △H=﹣75.56kJ·mol-1
2CO (g)+O2 (g)=2CO2 (g) △H=﹣566.0kJ·mol-1
写出 CO (g)与 I2O5 (s)反应析出固态 I2 的热化学方程式:_____,若这个反应一定能自发进行,则反应的△S_____0(填“>”,“<”或 “=”);
(2)某兴趣小组用 0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3 等试 剂,探究反应条件对化学反应速率的影响。
已知:Ⅰ、S2O82-+2I-=2SO42-+I2(慢) Ⅱ、I2+2S2O32-=2I- +S4O62-(快)
①向 KI、Na2S2O3 与淀粉的混合溶液中加入一定量的 K2S2O8 溶液,当溶液中的_____耗 尽后,溶液颜色将由无色变成为蓝色。 请从碰撞理论的角度解释上述产物未耗尽前溶液中看不到蓝色的原因:_____
②为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验 序号 | 体积 V/mL | ||||
K2S2O8 溶液 | 水 | KI 溶液 | Na2S2O3 溶液 | 淀粉溶液 | |
ⅰ | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
ⅱ | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
ⅲ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中 Vx=_____mL,理由是_____。
③已知某条件下,浓度 c (S2O82-)~反应时间 t 的变化曲线如图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时 c (S2O82-)~t 的变化曲线示意图 _____(进行相应的标注)
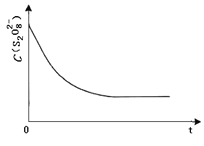
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含(NaOH 和 Na2CO3 或 Na2CO3 和 NaHCO3)混合碱,现称取试样 0.2960 克,以 0.1000mol·L-1的 HCl 标准溶液滴定,酚酞指示终点时消耗 20.00mL,再以甲基橙指示终点时,消耗盐酸为 VmL
(1)若 20.00<V<40.00 时,混合碱的组成为_______
(2)若 V>40.00,请列式计算以甲基橙指示终点时需要盐酸的体积为多少_______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3—CH=CH2+HBr→CH3—CHBr—CH3(主要产物),1 mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下面所示的一系列变化。
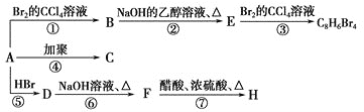
(1)A的化学式:________,A的结构简式________。
(2)上述反应中,①是________反应,⑦是________反应。(填反应类型)
(3)写出C,D,E,H物质的结构简式:
C_________,D_________,E_______,H________。
(4)写出DF反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作会使最终结果偏高的是( )
A.配制![]() 溶液,定容时俯视刻度线
溶液,定容时俯视刻度线
B.用![]() 盐酸滴定
盐酸滴定![]() 溶液,起始读数时仰视
溶液,起始读数时仰视
C.用湿润的pH试纸测定![]() 溶液的pH
溶液的pH
D.测定中和热的数值时,将![]() 溶液倒入盐酸后,立即读数
溶液倒入盐酸后,立即读数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com